Резюме
Остеоартроз (ОА) сопровождается развитием болевого синдрома, функциональных нарушений, приводящих к временной и стойкой утрате трудоспособности. Поиск средств лечения связан с расширением представлений о механизмах развития заболевания. В патогенезе ОА ведущая роль уделяется дегенеративно-дистрофическому процессу в суставном хряще и метаболическим нарушениям в субхондральной кости, приводящим к воспалению синовиальной оболочки. При этом остается дискуссионным вопрос о первоначальной инициации процесса и влиянии различных факторов на прогрессирование данного заболевания [1]. Меньше внимания уделяется изменениям периартикулярных структур. В то же время ослабление корсетирующей функции сустава в результате микротравматизации сухожильно-связочных структур, несомненно, ухудшает течение суставного процесса.
Сухожилия и связки суставов обладают болевой и проприоцептивной чувствительностью, что влияет на функциональное состояние околосуставных мышц, а при патологических процессах обуславливает развитие болевого ноцицептивного синдрома.
Физиологические и морфологические параметры сухожилий обеспечиваются тканевыми регулирующими механизмами, в частности изменением интенсивности продуцирования хондроитинсульфата и гиалуроновой кислоты, и связаны с функциональной нагрузкой.
Согласно современным рекомендациям, лечение ОА включает применение лекарственных, нефармакологических и хирургических методов, направленных на уменьшение болевого синдрома, улучшение подвижности сустава [2—6]. При этом остается малоизученным вопрос о возможности влияния медикаментозной коррекции на регенерацию сухожильно-связочных структур суставов. В связи с вышесказанным нами проведено экспериментальное моделирование повреждения ахиллова сухожилия с последующей медикаментозной коррекцией с использованием биоактивного концентрата мелких морских рыб (Алфлутоп), который содержит гликозаминогликаны (хондроитин-4сульфат, хондроитин-6-сульфат, дерматансульфат, кератансульфат), аминокислоты, пептиды, микроэлементы (Ca, Na, K, Fe, Cu, Zn), полученные по запатентованной технологии. Данный комплекс обладает многими терапевтическими свойствами. В экспериментальных исследованиях подтверждено влияние препарата Алфлутоп на стимулирование пролиферации хондроцитов и на синтез внеклеточного матрикса посредством модуляции ТРФ-бета. Также получены данные о влиянии препарата на стабилизацию внеклеточного матрикса посредством ингибирования гиалуронидазы. Алфлутоп демонстрирует антиоксидантную активность и ингибирование активности генов провоспалительных цитокинов ИЛ-6 и ИЛ-8. Этот факт определяет антицитокиновый эффект препарата Алфлутоп, который реализуется на генетическом и фенотипическом уровнях. Кроме того, установлена способность препарата ингибировать активность VEGF, инициирующего ангиогенез и деструктивные процессы при ОА [7, 8]. Имеются единичные клинические работы, подтверждающие эффективность препарата при повреждении связок коленного сустава, при поражении периартикулярных структур плечевого сустава [9, 10]. Полученные данные свидетельствуют как об улучшении функциональных возможностей, так и об уменьшении болевого синдрома при приеме лекарственного средства Алфлутоп.
Цель настоящего исследования — изучение репарации посттравматического повреждения сухожилий с использованием оригинального биоактивного концентрата мелких морских рыб (Алфлутоп).
Материалы и методы исследования
Эксперименты проводились на 60 половозрелых аутбредных белых крысах-самцах в возрасте 3—4 мес собственного разведения при начальной массе 200—220 г, разделенных на две группы — опытную и контрольную. Животные содержались в стандартизированных условиях вивария при температуре 20—22 °C. Эксперимент планировался и осуществлялся в соответствии с Anesthesia and Analgesia in Laboratory Animals at UCSF. The Regents of the University of California (http://www.iacuc.ucsf.edu/Proc/awRbtFrm.asp) [11] и Национальным стандартом РФ ГОСТ Р 56701-2015 от 01.07.16 «Лекарственные средства для медицинского применения. Руководство по планированию доклинических исследований безопасности с целью последующего проведения клинических исследований и регистрации лекарственных средств» [12].
В качестве питья использовали воду питьевую артезианскую «Чусовская», очищенную, высшей категории качества (Свидетельство о государственной регистрации №66.01.31.013.У.000009.03.10 от 22.03.10). Крысы получали полнорационный комбикорм ООО «Лабораторкорм», который сбалансирован по аминокислотному составу, минеральным веществам и витаминам (ТУ 10.92.10-00600933051-2018). При содержании животных использовался кукурузный подстил (ТУ 9692-002-94001750-2008).
Травматическое повреждение пяточного сухожилия осуществлялось с помощью продольной тракции зажимом Бильрота после предварительной анестезии животного золетилом 100 мг в 1 мл из расчета 4 мг на 100 г массы животного. Затем выполнялись послойные швы на рану атравматической иглой, внутрикожный шов.
Лечебное действие препарата Алфлутоп исследовали при ежедневном внутримышечном введении 0,05 мл в течение 30 дней с промежуточными сроками умерщвления 10, 20 дней. Расчет дозировки исходил из данных об общей калорийности рациона лабораторной крысы в виварии около 100—110 ккал и калорийности рациона питания человека 2000—2200 ккал. Так, если рекомендуемая дозировка препарата Алфлутоп для человека составляет 1 мл при вышеуказанной калорийности питания, то для крысы — 0,05 мл.
Выведение из эксперимента животных проводилось путем внутримышечного введения повышенной дозы медитина и золетила. Эвтаназия происходила в три срока: 10, 20 и 30 дней. По окончании каждого срока эксперимента тканевые образцы (фрагменты нижних конечностей крыс) фиксировались в 10% нейтральном формалине для последующего морфологического исследования. В группах сравнения (опытная группа получала коррекцию исследуемым препаратом, контрольная группа — без коррекции) и в группе интактного контроля (норма) проведена вырезка материала с выделением пяточных (ахилловых) сухожилий. Образцы сухожилий проводили по спиртам возрастающей концентрации, заливали в парафин на станции Microm EC-350 с продольной и поперечной ориентацией сухожилий. Парафиновые блоки с образцами микротомировали на аппарате Leica RM2245. Гистологические препараты окрашивались гематоксилином-эозином (гематоксилин карацци, эозин 1% водный раствор), пикрофуксином по Ван Гизону на коллагеновые волокна, по Вейгерту на эластические волокна. Готовые гистологические препараты исследовали на микроскопе Olympus СХ41 при увеличениях ×40, ×100, ×200, ×400, ×600 с применением стандартных объективов. Для документирования выявленных патоморфологических изменений проводили сканирование и микрофотосъемку с использованием системы Biosystems Scanning Aperio CS2 Leica.
Для объективизации полученных при световой микроскопии данных проведены морфометрические исследования. В гистологических препаратах сухожилий в группах сравнения в зоне повреждения динамику созревания новообразованной соединительной ткани оценивали по соотношению в ней удельной доли (в %) волокнистых и клеточных структур в разные сроки наблюдения после травматического повреждения сухожилия — через 10, 20 и 30 дней, измерение проводили с помощью сетки Автандилова и микроскопа Olympus CX41.
Также в эти же сроки (через 10, 20 и 30 дней) в сравниваемых группах животных проводилось измерение толщины новообразованных коллагеновых волокон (в микрометрах — мкм) (группа интактного контроля маркирована как «норма»). Морфометрические исследования в этом случае проводили с помощью микроскопа Olympus CX41, видеокамеры Hayear и программного продукта Phimias Ver 3.0. Математическая обработка проводилась с использованием непараметрического теста Манна—Уитни для сравнения независимых групп, так как по виду гистограммы распределение толщины волокон отличалось от нормального.
Результаты исследования
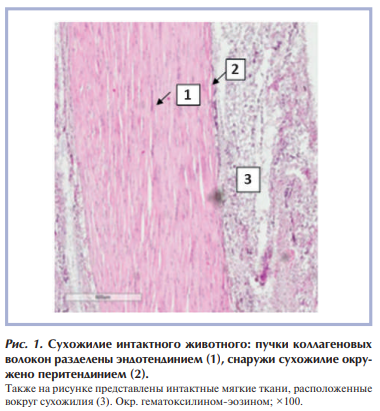
В группе интактного контроля (гистологическая норма) пяточное сухожилие крысы при микроскопическом исследовании в целом имеет строение, аналогичное строению сухожилия человека. Сухожилие представлено плотно упакованными, идущими параллельно друг другу однонаправленными пучками коллагеновых волокон (рис. 1). Между пучками коллагеновых волокон расположен эндотендиний, содержащий сосуды. Эндотендиний отделяет пучки коллагеновых волокон сухожилия друг от друга. Снаружи сухожилие покрыто перитендинием (рис. 2), представленным рыхлой соединительной тканью, здесь же присутствуют теноциты, единичные липоциты. Все сухожилие окружено мягкими тканями (на препаратах это жировая и мышечная ткань). В пучках самого сухожилия, между коллагеновыми волокнами, в небольшом количестве присутствуют теноциты — фибробластоподобные клетки вытянутой формы с узкими, удлиненными ядрами и узким ободком цитоплазмы. Для выполнения функции сухожилие должно не только быть прочным, но и иметь механизмы, снижающие силу трения при его движении. Этому способствует особое строение наружной оболочки сухожилия — перитендиния, которая окружает сухожилие и отделяет его от мягких тканей. Перитендиний имеет два слоя, разделенных капиллярным слоем и жидкостью для скольжения, при этом внутренний слой (эпитендиний) покрывает сухожилие, а наружный слой (перитенон) граничит с окружающими мягкими тканями.
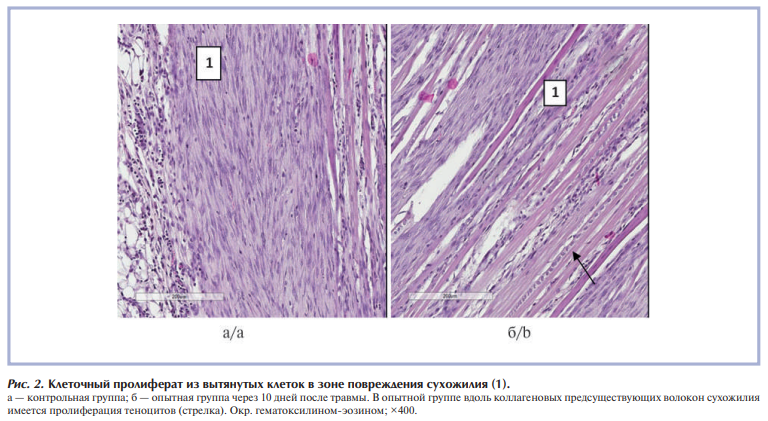
Через 10 дней после травмы в пяточных сухожилиях крыс в обеих группах сравнения в зоне повреждения на фоне сохраняющейся реакции экссудации разной степени выраженности запускалась реакция пролиферации: зона повреждения замещалась клеточным пролифератом из вытянутых веретеновидных клеток, среди которых определялись новообразованные тонкостенные сосуды, в небольшом количестве присутствовали мононуклеары. В целом такой клеточный пролиферат представлял собой стадию развития грануляционной ткани с начальными признаками организации (рис. 2). В опытной группе вблизи грануляционной ткани выявлялась пролиферация теноцитов, которые округлялись и располагались в виде цепочек вдоль коллагеновых волокон.
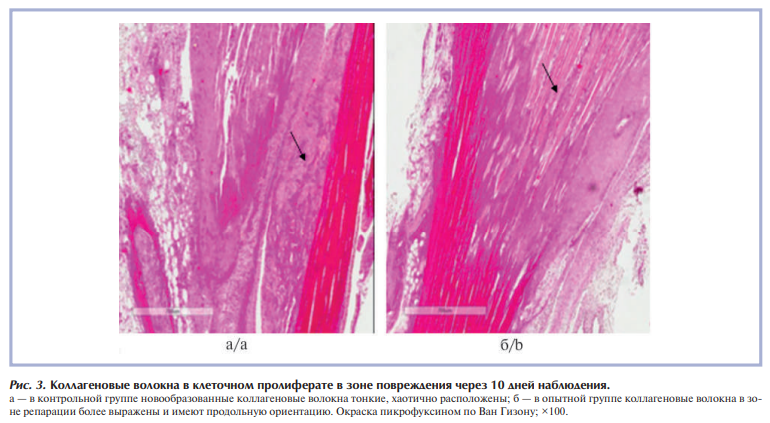
При окраске пикрофуксином по Ван Гизону на коллагеновые волокна выявлено, что уже через 10 дней в обеих группах сравнения в клеточном пролиферате в зоне повреждения сухожилия начинают появляться новообразованные тонкие коллагеновые волокна. При этом в контрольной группе (без коррекции) эти новообразованные волокна тонкие, хаотично расположены, в опытной группе в клеточном пролиферате новообразованные коллагеновые волокна имеют продольную направленность и определяются в большем количестве (рис. 3).
В эндотендинии сухожилия в этот срок наблюдения также имеются некоторые различия: в контрольной группе экссудативная реакция более выражена, эндотендиний расширен, полнокровен, отечен, с воспалительной инфильтрацией мононуклеарами с примесью эозинофилов, в опытной группе в эндотендинии определяется небольшое количество рыхло лежащих мононуклеаров и небольшой отек (рис. 4).
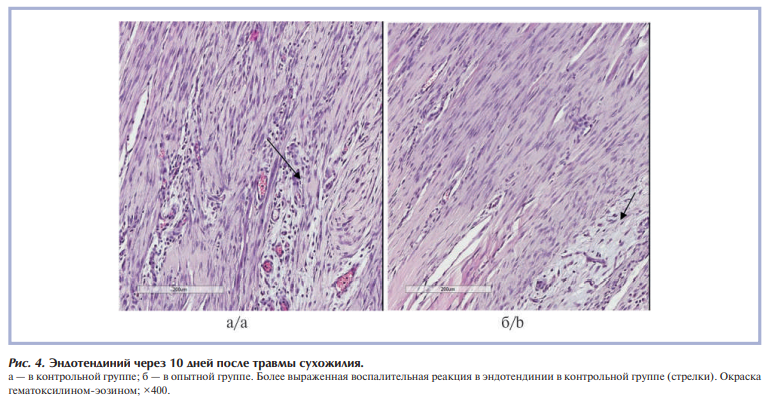
В окружающих сухожилие мягких тканях в контрольной и опытной группах сохраняется воспалительная реакция, в контрольной группе воспалительная реакция в окружающих тканях более выражена, в процесс вовлечены мягкие ткани, инфильтраты окружают нервные пучки, в опытной группе воспалительная реакция выражена в меньшей степени.
Через 20 дней после травмы в зоне повреждения в сухожилиях животных в обеих группах в клеточном пролиферате нарастают процессы организации. В этот срок наблюдения зона репарации представлена клеточным пролифератом, прорастающим коллагеновыми волокнами. При этом в опытной группе коллагеновые волокна формируют более или менее продольно направленные пучки. В контрольной группе зона повреждения замещена соединительной тканью разной степени зрелости: имеются участки рубцовой ткани, наряду с этим сохраняются участки из рыхлой соединительной ткани с воспалительной реакцией.
Через 30 дней после травмы в сухожилиях животных контрольной группы (без коррекции) зона повреждения замещена сухожилоподобной соединительной тканью с коллагеновыми разнонаправленными волокнами, среди которых сохраняются включения рыхлой соединительной ткани с небольшим количеством мононуклеаров или грубой рубцовой тканью (рис. 5, а). В этот же срок исследования у животных опытной группы зона повреждения замещена сухожилоподобной соединительной тканью, представленной пучками продольно ориентированных коллагеновых волокон (рис. 5, б); фокусов грубой рубцовой ткани или, наоборот, неоформленной рыхлой соединительной ткани ни в одном из образцов сухожилий из этой группы не выявлено. Реактивные воспалительные изменения отсутствуют. Сохраняется небольшая пролиферативная реакция в теноцитах, в некоторых образцах сохраняется пролиферативная активность в перитендинии. Следует отметить, что, по данным некоторых авторов, перитендиний и теноциты являются источниками репаративных процессов при повреждении сухожилий.
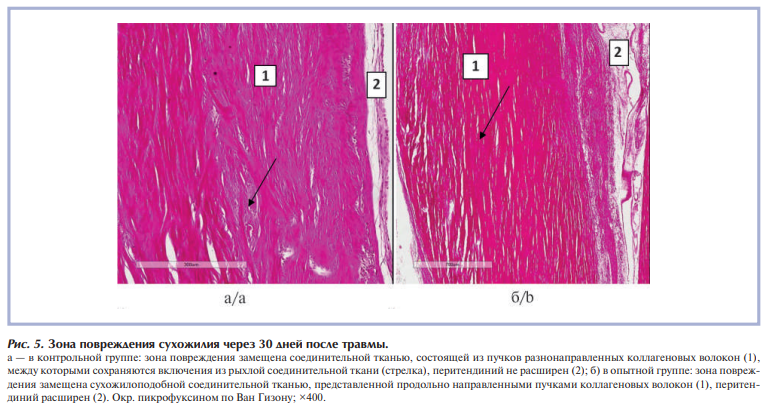
В обеих группах имелись отдельные наблюдения с формированием рубцовых спаек сухожилия с окружающими мягкими тканями, что могло быть связано не только с реактивной воспалительной реакцией в ранние сроки, но и с выраженностью самого механического повреждения.
Для оценки эластического каркаса сухожилия и его восстановления в зоне повреждения была проведена дополнительная окраска гистологических срезов по Вейгерту на эластические волокна. У интактных животных (норма) в сухожилии коллагеновые волокна сопровождаются тонкими нитями эластических волокон. В наших наблюдениях при повреждении сухожилия в зоне репарации восстановления эластического каркаса ни в одной из групп не происходило. В опытной группе встречались только единичные небольшие фрагменты эластических волокон около новообразованных коллагеновых волокон.
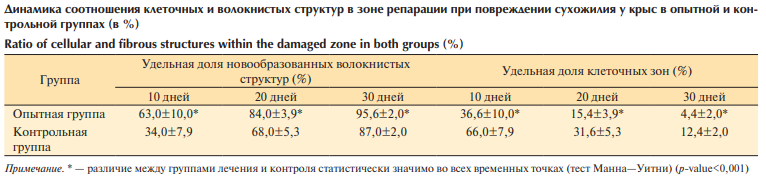
По данным морфометрии, в опытной группе, получавшей препарат Алфлутоп, скорость созревания новообразованной соединительной ткани (регенерата) в сухожилии после повреждения выше, чем в контрольной группе: уже через 10 дней процентное содержание новообразованных волокнистых структур в 2 раза превышало этот показатель в контрольной группе (без коррекции препаратом), в контрольной группе в этот срок в регенерате преобладали еще клеточные зоны рыхлой неоформленной соединительной ткани с элементами воспаления. Через 20 и 30 дней в опытной и контрольной группах доля новообразованных коллагеновых волокон возрастает, однако в опытной группе этот показатель сохраняет более высокие значения (см. таблицу). По удельной доле клеточных зон в области репарации различие между группами лечения и контроля статистически значимо во всех временных точках (10, 20, 30 дней).
В опытной группе (с использованием лекарственного средства Алфлутоп ) средняя толщина новообразованных волокон через 10 дней после повреждения сравнима с показателями контрольной группы (без коррекции), но количество этих волокон в контрольной группе значительно ниже, чем в опытной группе, что хорошо видно при сопоставлении с данными таблицы и данными световой микроскопии. При гистологическом исследовании было показано, что в этот срок в контрольной группе (без коррекции) зона репарации представлена еще незрелой рыхлой соединительной тканью с единичными хаотичными тонкими волокнистыми структурами, тогда как в опытной группе в зоне репарации уже появляются продольно ориентированные тонкие коллагеновые волокна. Через 20 дней толщина коллагеновых волокон в опытной группе нарастает более существенно, чем в контрольной группе (1,4 мкм против 1,0 мкм). К 30-му дню наблюдения существенного различия в средних показателях толщины коллагеновых волокон в группах сравнения нет, однако в опытной группе все новообразованные коллагеновые волокна по толщине достаточно однородны.
В обеих группах сравнения через 30 дней толщина коллагеновых волокон в зоне репарации сухожилия при повреждении ниже, чем толщина коллагеновых волокон сухожилия интактных крыс этой же партии (средняя толщина коллагеновых волокон в норме 2,5 мкм против 1,5 мкм в опытной группе и 1,4 мкм в контрольной группе).
Обсуждение результатов
Сухожильная ткань является исключительно прочной благодаря тому, что она состоит преимущественно из продольно ориентированных коллагеновых и эластических волокон. Процесс регенерации сухожилия включает три стадии: воспаление, регенерация (с 5-го по 28-й день), организация и ремоделирование [13—16]. К окончанию первой стадии регенерации в зоне повреждения кумулируются фибробласты (активно проводят синтез коллагена I и III типов, при этом коллаген III типа ориентирован неупорядоченно). Синхронно с этим протекает процесс синтеза волокон коллагена I типа, ориентированных по линии нагрузки. Считается, что подложкой для коллагеновых волокон служит фибронектин. Трансформирующий фактор роста в этот период достигает максимальных значений. В зону фибронектиновой подложки и образования коллагена идет врастание сосудов из оболочек сухожилия и синовиальной сумки, образуется клеточный регенерат с большим количеством сосудов, а далее — нарастание в регенерате коллагеновых волокон.
Третья стадия регенерации (ремоделирование) происходит с 5-й недели по 112-й день и заключается в стабилизации физиологического состояния сухожилия. Плотность клеток уменьшается, что сопровождается снижением биосинтеза макромолекул. В межклеточном веществе увеличивается содержание коллагена I типа, повышается плотность коллагеновых волокон, снижается содержание коллагена III типа. В соответствии с организацией коллагеновых волокон в пучки повышается прочность сухожилия на разрыв [14]. Однако полного восстановления сухожилия после травматического повреждения достичь трудно, так как в области травматического повреждения формируется рубцовая ткань, сохраняется повышенная плотность фибробластов и имеется неравномерность толщины коллагеновых волокон с преобладанием тонких фибрилл, нарушена продольная ориентация волокон, остается много сосудов в формирующемся регенерате, все это нарушает прочность сухожилия. Считается, что окончательная перестройка при повреждении сухожилия идет неопределенно долго.
Проведенное морфологическое исследование показало, что при повреждении сухожилия репаративные процессы при использовании биоактивного концентрата (опытная группа) протекали более синхронизированно, чем в контрольной группе, что привело к формированию в зоне повреждения сухожилоподобной ткани из продольно направленных пучков коллагеновых волокон, напоминающих строение предсуществующего сухожилия уже к 30-му дню наблюдения. В контрольной группе (без коррекции) к 30-му дню после травмы зона повреждения замещена неоднородной по степени зрелости и строению соединительной тканью, включающей в себя участки грубой рубцовой и сухожилоподобной ткани из разнонаправленных пучков коллагеновых волокон, чередующихся с рыхлой неоформленной тканью. Такое неоднородное строение зоны репарации в сухожилии, вероятно, будет ограничивать функциональные возможности.
В некоторых образцах из опытной группы через 30 дней после повреждения сохраняется функциональная активность теноцитов и перитендиния, о чем свидетельствуют их структурные изменения — укрупнение и округление теноцитов, расположенных в виде цепочек вдоль коллагеновых волокон, расширение перитендиния. Это, возможно, также связано со способностью препарата влиять на улучшение репаративных процессов в сухожилии.
Поскольку при повреждении сухожилия регенерация идет с участием камбиальных элементов, а не теноцитов, которые являются высокодифференцированными клетками, для оценки динамики созревания соединительной ткани в группах сравнения для морфометрии нами были выбраны три показателя: удельная доля клеточных элементов и новообразованных волокнистых структур, а также толщина коллагеновых волокон. Скорость формирования рубцовой ткани происходила быстрее в группе получавших лечение: уже через 10 дней процентное содержание новообразованных волокнистых структур в 2 раза превышало этот показатель в контрольной группе (без коррекции препаратом), в контрольной группе в этот срок в регенерате преобладали еще клеточные зоны рыхлой неоформленной соединительной ткани с элементами воспаления. Хотя на 20-й и 30-й дни исследования этот показатель улучшался и в контрольной группе, однако в опытной группе этот показатель сохранял более высокие значения, имея высокое статистическое отличие (p-value<0,001).
К 30-му дню наблюдения существенного различия в средних показателях толщины коллагеновых волокон в группах сравнения нет, однако в опытной группе все новообразованные коллагеновые волокна по толщине достаточно однородны, что, возможно, имеет значение для сохранения механических свойств сухожилия в зоне репарации, тогда как в контрольной группе (без коррекции) толщина новообразованных волокон значительно варьирует (то есть, в формирующемся регенерате имеются коллагеновые волокна разной толщины, встречаются участки гиалиноза).
Во всех сроках исследования не получено достоверных различий по показателю «толщина коллагеновых волокон в зоне репарации сухожилия». Полученные результаты согласуются с данными литературы, подтверждающими, что репарация сухожилия продолжается более длительное время, чем в нашем исследовании.
Таким образом, полученные результаты морфометрии подтверждают выявленные при световой микроскопии различия в группах сравнения.
Заключение
Полученные при сравнительном морфологическом исследовании результаты позволяют сделать следующие выводы:
1. При экспериментальном моделировании посттравматического повреждения сухожилий в опытной группе с использованием биоактивного концентрата в ранние сроки репарации воспалительный компонент оказался менее выражен, чем в контрольной группе (без коррекции).
2. Процессы организации клеточного пролиферата, а именно синтез коллагеновых волокон и упорядоченное их расположение, при использовании биоактивного концентрата отмечено в более ранние сроки, чем в контрольной группе.
3. В группе с использованием биоактивного концентрата (опытная группа) репаративный процесс протекал более синхронно и к концу наблюдения (к 30-му дню) отмечено образование в зоне повреждения сухожилоподобной ткани, представленной продольно направленными пучками коллагеновых волокон, строение которой напоминало предсуществующее сухожилие, но без восстановления эластического каркаса. При этом в группе сравнения (контрольная группа без коррекции) в зоне повреждения сформировалась неоднородная по строению соединительная ткань разной степени зрелости (от фиброзной до рыхлой соединительной).
4. При морфометрическом исследовании получены данные, что скорость формирования рубцовой ткани происходила быстрее в группе животных, получавших препарат Алфлутоп, это подтверждается двукратным превышением процентного содержания новообразованных волокнистых структур по сравнению с контрольной группой.
Таким образом, использование оригинального биоактивного концентрата мелких морских рыб улучшает репаративный процесс после травматического повреждения сухожилий, что обусловлено его противовоспалительным действием и активацией процессов организации клеточного пролиферата сухожилия. Можно полагать, что данный биоактивный концентрат также оказывает аналогичный эффект на схожие по анатомо-морфологической структуре связки суставов, это в конечном счете может обуславливать антиноцицептивный (противоболевой) эффект и улучшение функциональных возможностей суставов.
Авторы заявляют об отсутствии конфликта интересов.