Резюме
Одним из способов повышения приверженности пациентов терапии остеоартрита (ОА) может быть использование более удобных схем применения препаратов.
Цель исследования – оценить эффективность препарата Алфлутоп® в альтернирующем режиме по сравнению со стандартным его введением у пациентов с ОА коленных суставов.
Пациенты и методы. В исследование включено 130 пациентов с первичным тибиофеморальным ОА коленных суставов II–III стадии по Келлгрену–Лоуренсу, с интенсивностью боли при ходьбе не менее 40 мм по визуальной аналоговой шкале, потребностью в приеме нестероидных противовоспалительных препаратов (не менее 30 дней за предшествующие 3 мес). Пациенты были распределены в две группы: больные 1-й группы получали Алфлутоп® по 2 мл внутримышечно (в/м) через день (всего 10 инъекций), пациенты 2-й группы – по 1,0 мл в/м ежедневно в течение 20 дней. Длительность участия пациента в исследовании составила 14 нед.
Результаты и обсуждение. У больных обеих групп уже к 20/21-му дню лечения зафиксировано статистически значимое (p<0,001) уменьшение боли в коленных суставах при ходьбе и всех показателей WOMAC (боль, скованность, функциональная недостаточность). Дальнейшее уменьшение боли и показателей WOMAC наблюдалось на протяжении 1 мес и более после завершения терапии (p<0,001), что свидетельствует о выраженном последействии препарата. Также в течение всего периода исследования отмечалось статистически значимое улучшение качества жизни по EQ-5D (р<0,001). С полученными данными согласовывалась и оценка по критерию OMERACT-OARSI. К моменту завершения лечения на терапию ответили 84,6% пациентов 1-й группы и 81,5% пациентов 2-й группы.
Выводы. Данные настоящего исследования подтверждают сопоставимую высокую эффективность Алфлутопа® как при стандартном, так и при альтернирующем режиме терапии. На фоне лечения отмечены значимое уменьшение выраженности боли, улучшение функции коленных суставов и качества жизни. Показана возможность назначения препарата не только ежедневно №20 по 1 мл, но и через день №10 по 2 мл.Остеоартрит (ОА) – наиболее распространенное заболевание суставов и одна из самых частых причин обращения пациентов за медицинской помощью. По данным исследования Global Burden of Disease Study, опубликованного в журнале Lancet в 2018 г., ОА страдают более 300 млн человек в 195 странах, при этом наблюдается постоянный рост количества лет, прожитых населением в состоянии нетрудоспособности (YLDs) по причине ОА [1]. Так, с 1990 по 2007 г. этот показатель увеличился на 63,1% (61,5–64,9), а с 2007 по 2017 г. – на 31,4% (30,7–32,1) и в 2017 г. в среднем составил 9,6 млн человек (4,8–19,1) [1].
Учитывая высокую распространенность и социальную значимость ОА, одним из стратегических направлений медицины является разработка новых и совершенствование уже существующих методов его лечения, направленных не только на уменьшение боли и улучшение функционального состояния суставов, но и на предотвращение/замедление прогрессирования заболевания. Терапевтический алгоритм при ОА предполагает применение как нефармакологических, так и медикаментозных методов, среди которых приоритет принадлежит симптоматическим препаратам замедленного действия (Symptomatic Slow-Acting Drugs in Osteoarthritis, SYSADOA). Уже в 2014 г. Европейское общество по клиническим и экономическим аспектам остеопороза и остеоартрита ESCEO (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases) включило SYSADOA, в частности хондроитина сульфат и глюкозамина сульфат, в пошаговый алгоритм лечения ОА коленных суставов в качестве препаратов первой линии. Также, согласно рекомендациям Ассоциации ревматологов России, Федеральным клиническим рекомендациям по лечению ОА, консенсусу экспертов по ОА, препараты данной группы должны быть обязательно назначены пациенту, независимо от локализации заболевания, сразу после установления диагноза. SYSADOA оказывают как симптоматический (анальгетический, противовоспалительный), так и структурно-модифицирующий эффект, замедляя прогрессирование заболевания [2].
Результаты клинических исследований, выполненных в том числе в нашей стране, свидетельствуют о том, что при парентеральном введении SYSADOA анальгетический эффект развивается быстрее (в среднем в течение 1–1,5 мес), чем при использовании пероральных препаратов (к 8–12-й неделе лечения). Одним из парентеральных препаратов, который успешно применяется в ревматологической практике уже более 20 лет, является Алфлутоп®, представляющий собой стандартизированный стерильный экстракт из четырех видов мелкой морской рыбы. Механизм его действия заключается в подавлении продукции ряда провоспалительных медиаторов, в частности интерлейкина (ИЛ) 6, 8 и 1β, матриксных металлопротеиназ (ММР) 13, 3, ADAMTS4, ингибировании ангиогенеза, связанного с продукцией сосудистого эндотелиального фактора роста, а также стимуляции хондрогенеза (влияние на внеклеточное высвобождение тканевого фактора роста β и экспрессию гена SOX9) [3]. Помимо этого, препарат обладает и антиоксидантным эффектом за счет увеличения активности каталазы и уменьшения уровня внутриклеточного супероксид аниона/пероксид водорода [4].
Алфлутоп® широко используется для лечения ОА, имеет солидную доказательную базу, включающую двойные слепые рандомизированные клинические исследования, подтвердившие его анальгетический, противовоспалительный и структурно-модифицирующий эффект [5, 6]. Для изучения вариантов повышения приверженности терапии ОА было проведено открытое рандомизированное многоцентровое исследование эффективности и безопасности препарата Алфлутоп® у больных ОА коленных суставов в альтернирующем режиме: 2,0 мл внутримышечно (в/м) через день в течение 20 дней по сравнению со стандартным режимом: 1,0 мл в/м ежедневно в течение 20 дней.Материалы и методы исследования
В исследование были скринированы 134 пациента в 6 исследовательских центрах на территории Российской Федерации. Больные, удовлетворяющие всем критериям включения/невключения (n=130), на момент 2-го визита (неделя 0) были рандомизированы в две группы в соотношении 1:1 (по 65 пациентов). Дополнительно в обеих группах была проведена стратификация пациентов в зависимости от наличия/отсутствия следующих сопутствующих заболеваний: гипертоническая болезнь, сахарный диабет (СД) 2-го типа и дислипидемия. Пациенты 1-й группы получали Алфлутоп® по 2 мл в/м через день (всего 10 инъекций), пациенты 2-й группы – по 1 мл в/м ежедневно в течение 20 дней.Критерии включения в исследование:
Мужчины и женщины 40–75 лет с первичным тибиофеморальным OA коленных суставов, соответствующие критериям ACR (1986), боль при ходьбе – не менее 40 мм по визуальной аналоговой шкале (ВАШ), II или III рентгенологическая стадия по Келлгрену–Лоуренсу, потребность в приеме нестероидных противовоспалительных препаратов (НПВП) в стабильной дозе не менее 30 дней за предшествующие 3 мес, подписанное информированное согласиеКритерии невключения:
Сопутствующие воспалительные заболевания или заболевания/состояния, которые приводят к повреждению суставов (ревматоидный артрит, метаболические заболевания костей, псориаз, подагра, хондрокальциноз и др.); выраженная (требующая хирургического лечения) вальгусная или варусная деформация коленного сустава, слабость связочного аппарата или разрушение мениска; сопутствующий ОА тазобедренного и/или голеностопного сустава в тяжелой стадии, который может затруднить оценку эффективности терапии или боли в коленном суставе; септический артрит какого-либо сустава в анамнезе или подозрение на наличие подострого инфекционного воспаления в таргетном суставе; хирургическое лечение таргетного коленного сустава в анамнезе; запланированная на время проведения исследования операция на любом суставе нижних конечностей; лимфовенозная недостаточность нижних конечностей III стадии; заболевания и сопутствующие состояния, влияющие на структуру и плотность костной ткани (гиперпаратиреоидная остеодистрофия, синдром мальабсорбции, остеомаляция, несовершенный остеогенез и др.); следующие отклонения лабораторных показателей: содержание гемоглобина <100 г/л, общий билирубин ≥2,0 верхних границ нормы (ВГН), уровень аспартатаминотрансферазы (АСТ) или аланинаминотрансферазы (АЛТ) ≥2,5 ВГН, скорость клубочковой фильтрации (по формуле Кокрофта–Голта) <60 мл/мин; тяжелые сердечно-сосудистые заболевания в настоящее время или в течение 12 мес до рандомизации, в том числе: хроническая сердечная недостаточность класса III или IV (по классификации Нью-Йоркской кардиологической ассоциации), клинически значимые желудочковые аритмии (желудочковая тахикардия, фибрилляция желудочков), нестабильная стенокардия, инфаркт миокарда, операции на сердце и коронарных сосудах, значимые заболевания клапанов сердца, неконтролируемая артериальная гипертензия с систолическим артериальным давлением (АД) >180 мм рт. ст. и диастолическим АД >110 мм рт. ст., легочная эмболия или тромбоз глубоких вен; СД 1-го типа и неконтролируемый СД 2-го типа (HbA1c >10,5%, уровень глюкозы плазмы натощак >15 ммоль/л на момент скрининга или эпизоды тяжелой гипогликемии в течение 1 мес до скрининга); индекс массы тела (ИМТ) ≥40 кг/м2; тяжелые заболевания центральной нервной системы, в том числе судороги в анамнезе или состояния, которые могли привести к их развитию; инсульт или транзиторная ишемическая атака в течение 12 мес до скрининга; черепно-мозговые травмы или случаи потери сознания в течение 12 мес до скрининга; опухоль головного мозга; заболевания, проявлявшиеся повышенной кровоточивостью (геморрагический васкулит, гемофилия, тромбоцитопения и т. д.), или состояния с высоким риском развития кровотечения; признаки выраженного неконтролируемого сопутствующего заболевания, например расстройства нервной системы, почек, печени, эндокринной системы, желудочно-кишечного тракта, которые, по мнению исследователя, могли препятствовать участию пациента в исследовании; участие в других клинических исследованиях или прием исследуемых препаратов в течение 4 нед до скрининга; ВИЧ, активный вирусный гепатит В и С, цирроз печени; злокачественные новообразования в течение последних 5 лет (за исключением базально-клеточного или плоскоклеточного рака кожи и карциномы in situ шейки матки, которые были иссечены и излечены); злоупотребление наркотиками или алкоголем на момент скрининга или в прошлом, которое, по мнению исследователя, исключало возможность участия в исследовании; беременные или кормящие женщины или женщины, планировавшие беременность во время клинического исследования; наличие в анамнезе гиперчувствительности к любому из компонентов исследуемого препарата; предшествующий прием системных глюкокортикоидов в течение 2 мес до скрининга, внутрисуставное введение любых препаратов в течение 4 нед до скрининга, прием пероральных SYSADOA для лечения ОА коленного сустава (хондроитина сульфат, глюкозамина сульфат, пиаскледин, диацереин и биологически активные добавки) в течение 3 мес до скрининга, прием бисфосфонатов, стронция ранелата, заместительной гормональной терапии, препаратов паратиреоидного гормона, препаратов моноклональных антител к RANKL, активных метаболитов витамина D в течение 12 мес до скрининга, а также других препаратов, способных влиять на метаболизм костной ткани (антиконвульсанты, анаболические стероиды и др.), за 4 нед до скрининга; неспособность читать или писать, нежелание понять процедуры протокола исследования и следовать им, а также любые другие сопутствующие медицинские или серьезные психические состояния, не позволяющие пациенту принимать участие в исследовании, ограничивающие правомерность получения информированного согласия.
Длительность участия пациента в исследовании составила 14 нед, число визитов – 5: В1 – визит скрининга; В2 – визит рандомизации (начало терапии); В3 – визит через день после последнего введения исследуемого препарата пациентам (для 1-й группы – 20-й день и для 2-й группы – 21-й день); В4 – визит через 2 мес после начала терапии; В5 – заключительный визит (через 3 мес) – телефонный звонок с целью регистрации возможных неблагоприятных реакций (НР). В качестве дополнительной терапии пациентам разрешался прием мелоксикама 7,5–15 мг/сут, а при наличии противопоказаний для использования НПВП – парацетамола 1–3 г/сут.
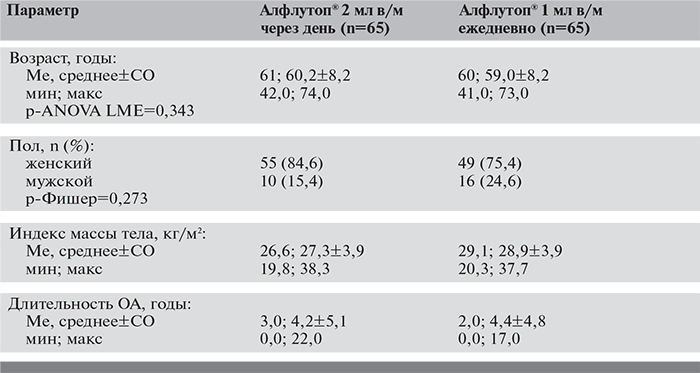
В исследуемые группы вошли больные в возрасте от 41 года до 74 лет, со средней длительностью заболевания 4 года и средним ИМТ, соответствующим избыточной массе тела (табл. 1). У большинства пациентов (у 75,4% в 1-й группе и у 70,8% во 2-й группе) определялась II рентгенологическая стадия ОА коленных суставов по Келлгрену–Лоуренсу. При сравнительном анализе установлена сопоставимость групп также по частоте сопутствующих заболеваний, которые выявлены в 96,9% случаев. Так, гипертоническая болезнь в 1-й группе диагностирована у 70,8% пациентов, во 2-й группе – у 67,7%, дислипидемия – у 50,8 и 60%, СД 2-го типа – у 6,2 и 4,6% соответственно (p>0,999).
Эффективность терапии оценивалась по динамике боли по ВАШ; показателей опросника WOMAC (боль, скованность и функциональная недостаточность, ФН); теста «Встань и иди»; качества жизни по ЕQ-5D; общей оценке больного (Patient’s Global Assessment, PGA) и общей оценке исследователя (Investigator’s Global Assessment, IGA); ответу на терапию по критериям OMERACT-OARSI.
Статистический анализ
Использовали программный пакет R (The R Project for Statistical Computing, http://www.r-project.org). Все статистические тесты являлись двусторонними, с уровнем значимости 5%; все доверительные интервалы (ДИ) являлись двусторонними 95%; непрерывные данные представлены числом наблюдений, средним значением со стандартным отклонением (СО), медианой (Ме) и диапазоном значений; дискретные величины описаны абсолютными и относительными частотами.
Анализируемые популяции
Модифицированная популяция пациентов, проходивших лечение (Modified Intent-To-Treat, MITT), включала всех больных (n=130), которые получили не менее одной в/м инъекции исследуемого препарата и имели по крайней мере одну оценку по опроснику WOMAC после исходной. Популяция MITT являлась основной для анализа эффективности терапии.
Популяцию по протоколу (Per Protocol, РР) составили все пациенты популяции MITT, которые полностью завершили исследование, имели оценки для первичного анализа эффективности и считались комплаентными. К комплаентным относились больные, у которых не зафиксировано каких-либо серьезных нарушений протокола исследования. В популяцию PP вошли 125 пациентов: 63/65 (96,9%) из 1-й группы и 62/65 (95,4%) из 2-й группы. Во всех случаях причиной исключения стало нарушение протокола.
Результаты оценки эффективности терапии представлены только для популяции МITT, поскольку популяции МITT и PP существенно не различались.
Оценка по WOMAC
Группы терапии сравнивались при исходном визите с использованием смешанной линейной модели (LME), в качестве независимой переменной учитывалась оценка боли по WOMAC. В индивидуальной регистрационной карте была зафиксирована сумма по 5 подшкалам боли, для оценки вычислялось среднее значение. Группа терапии была включена в модель как фиксированный эффект, а исследовательский центр – как случайный. На момент В4 также была построена LME, но в качестве независимой переменной учитывалось уже изменение по шкале WOMACболь. В модель был добавлен исходный уровень как коварианта и по этой формуле рассчитан двусторонний 95% ДИ.
Гипотезы:
H0: μ A – μ S≥ δ,
H1: μ A – μ S< δ ,
где μ A – изменение по шкале WOMACболь для альтернирующего режима (Алфлутоп® 2 мл в/м через день); μS – изменение по шкале WOMACболь для стандартного режима (Алфлутоп® 1 мл в/м ежедневно); δ – граница клинической значимости; H0 – альтернирующий режим дозирования уступает стандартному; H1 – альтернирующий режим дозирования не уступает стандартному.
Планировалось отклонить нулевую гипотезу, если верхняя граница расчетного двустороннего 95% ДИ для разницы изменения индекса WOMACболь между группами составляла <9 мм.
Методика анализа скованности и ФН по WOMAC была аналогична оценке боли по WOMAC, однако межгрупповые сравнения представлены только для изменений параметра без ДИ для разности между группами.
Оценка боли по ВАШ проводилась с помощью статистического анализа, схожего с таковым WOMACболь, но без межгрупповых сравнений.
Оценка качества жизни и состояния здоровья пациентов осуществлялась с использованием опросника EQ-5D (EuroQol 5D) [7]. Учитывались 5 его разделов, которые позволяют охарактеризовать способность пациента перемещаться, обслуживать себя, заниматься привычной повседневной деятельностью, выполнять работу, в том числе по дому, участвовать в делах семьи, проводить досуг, а также определить наличие боли или дискомфорта и отдельных психологических проблем. Каждый раздел оценивался в зависимости от степени выраженности проблемы: 1 – нет нарушений; 2 – умеренные нарушения; 3 – выраженные нарушения. Оценки по каждому из этих 5 разделов составляли позиционный индекс. Каждый из индексов опросника (от 11111 до 33333) имел свой дробный весовой коэффициент.
Общая оценка состояния здоровья пациента (вторая часть опросника EQ-5D) проводилась по ВАШ, где 0 – наихудшее состояние, а 100 – наилучшее. Параметр также был представлен описательной статистикой по визитам исследования, межгрупповые сравнения не проводились. Идентичный анализ использовался при оценке ответа на терапию (OMERACТ-OARSI).
Подгрупповой анализ не проводился, так как между группами по стратификационным параметрам (коморбидность) значимых различий не выявлено. Расчеты по PGA, IGA, тесту «Встань и иди» будут представлены во втором сообщении.
Результаты исследования
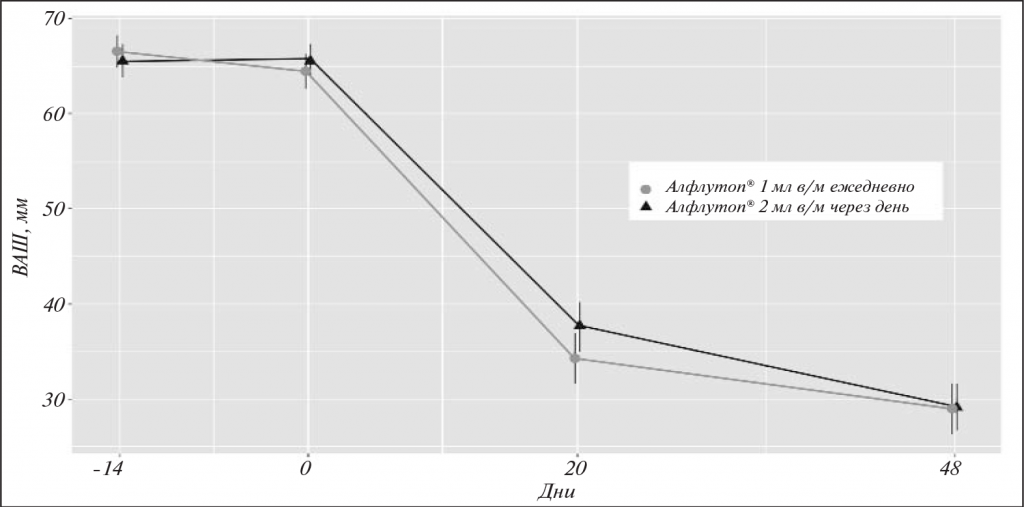
У больных обеих групп наблюдалось статистически значимое снижение боли в коленных суставах при ходьбе (p<0,001) уже к 20–21-му дню лечения (В3; табл. 2).
В частности, изменение Ме составило в 1-й группе -25,0 мм, во 2-й -32 мм (p<0,001). Дальнейшее уменьшение боли наблюдалось в течение 1 мес и более после завершения терапии (В4): Ме -36,0 и -40,0 мм соответственно (p<0,001), что может свидетельствовать об эффекте последействия препарата (рис. 1).
При анализе боли, скованности, ФН по WOMAC была выявлена аналогичная закономерность (см. табл. 2). Значимое снижение анализируемых показателей также наблюдалось к моменту завершения терапии (В3). Изменение Ме боли по WOMAC к 20–21-му дню лечения составило -18,8 мм в группе, получавшей Алфлутоп® в альтернирующем режиме, и -22,8 мм в группе стандартного приема препарата (p<0,001), скованности – -15,0 и -18,0 мм (p<0,001) и ФН – -16,6 и -14,2 мм соответственно (p<0,001). Через 2 мес после начала терапии (В4) наблюдалось дальнейшее уменьшение Ме боли (-21,8 мм в 1-й и -28 мм во 2-й группе; p<0,001), скованности (-21,5 и -25 мм; p<0,001) и ФН (-22,1 и -23,1 мм соответственно; p<0,001; рис. 2–4).
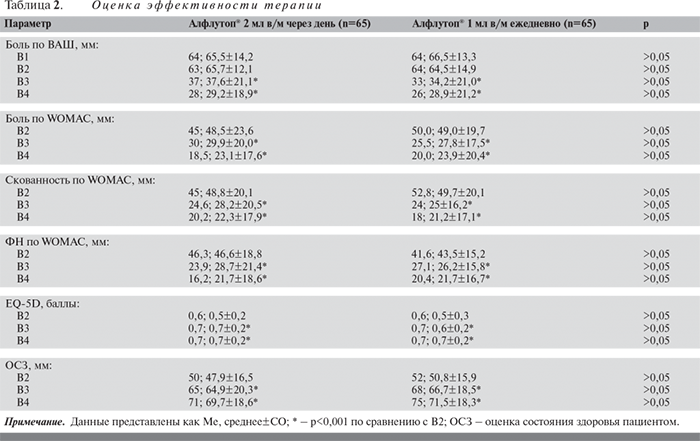
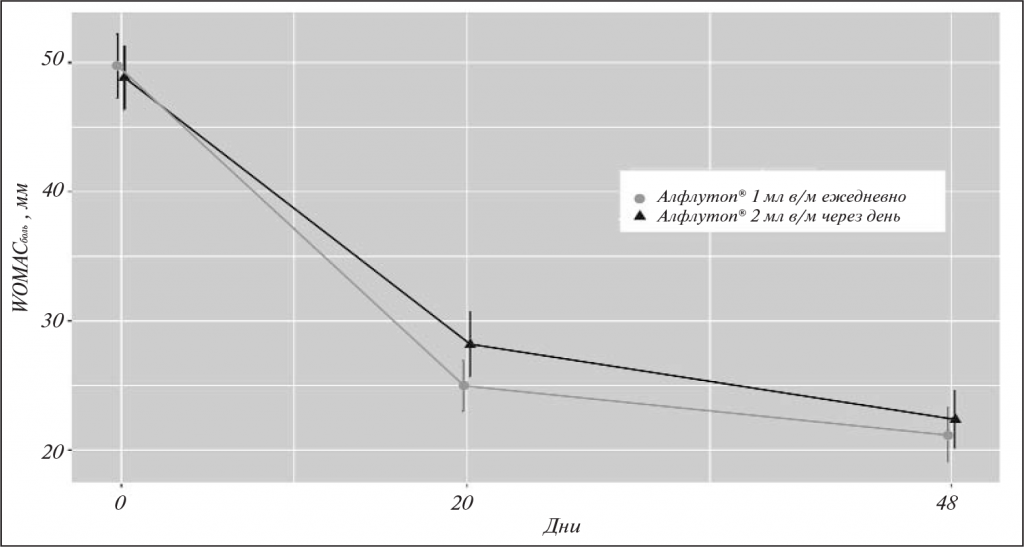
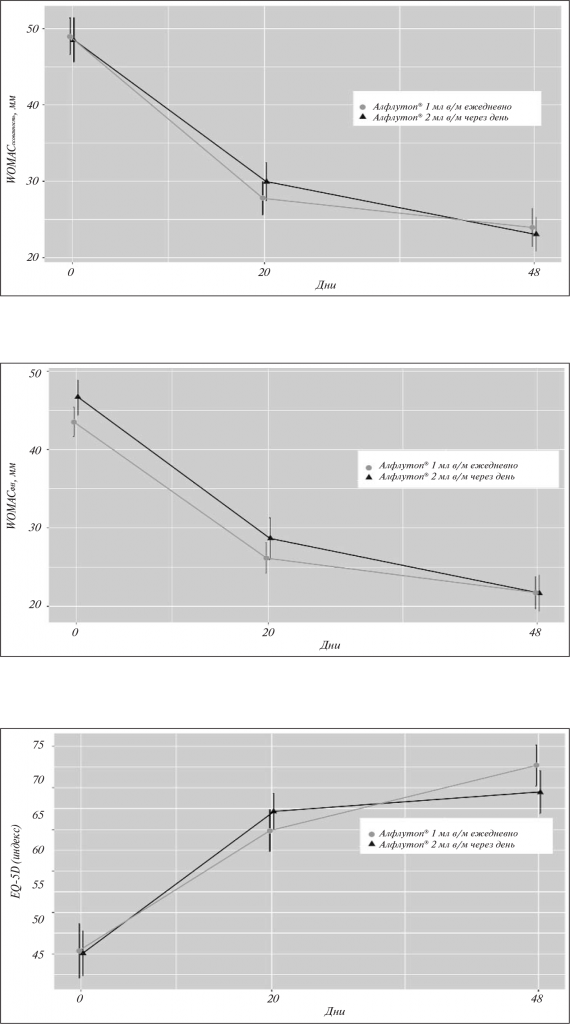
Улучшение качества жизни по EQ-5D отмечалось у пациентов обеих групп на протяжении всего периода наблюдения (см. табл. 1–2, рис. 5). Эффективность терапии подтверждается и показателями общей оценки состояния здоровья (по ВАШ). Так, по сравнению с исходными значениями к моменту В3 увеличение Ме составило +20,0 мм в группе альтернирующего лечения и +19,0 в группе стандартной терапии (p<0,001), а на момент В4 – уже +23,0 и +22,0 мм соответственно (p<0,001; см. табл. 1–2, рис. 6).
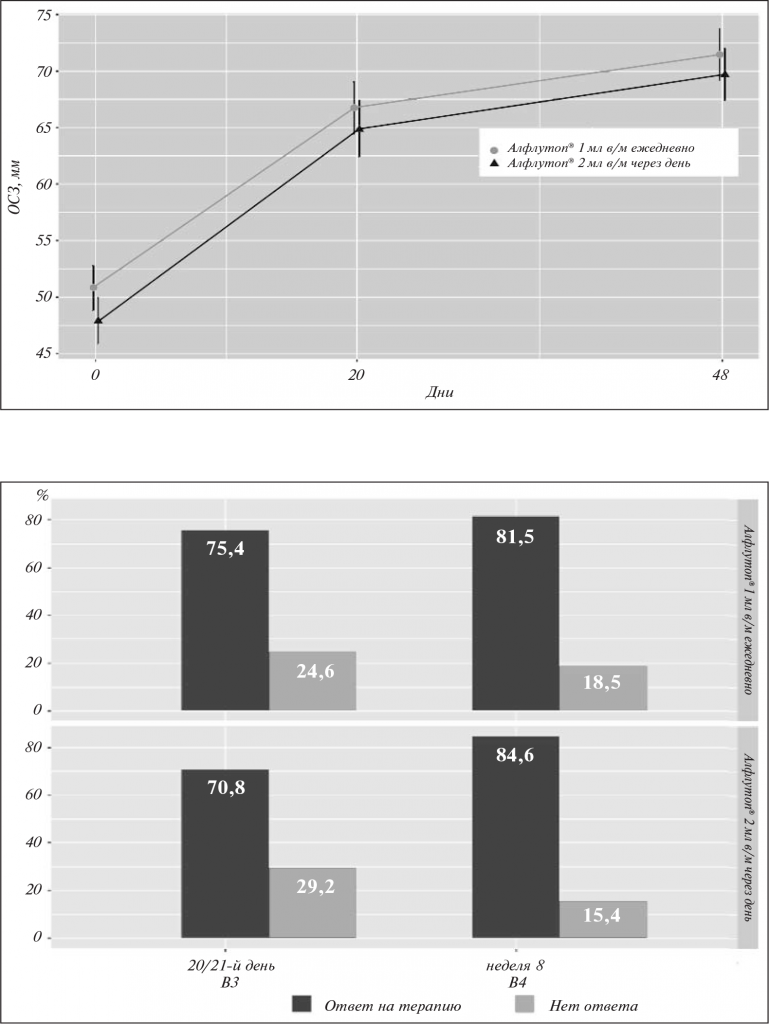
Особого внимания заслуживают данные, полученные при оценке по критерию OMERACT-OARSI: зафиксирован высокий процент ответа на терапию в обеих группах. Так, к завершению лечения положительный эффект отмечен у 70,8 и 75,4% пациентов 1-й и 2-й групп соответственно. Через 30 дней наблюдалось дальнейшее увеличение числа больных, ответивших на терапию, до 84,6 и 81,5% соответственно (рис. 7).
Таким образом, результаты многоцентрового клинического исследования свидетельствуют о том, что обе использованные схемы терапии имеют сопоставимый терапевтический потенциал, позитивно влияя на клинические проявления ОА.Обсуждение результатов
Полученные нами данные еще раз подтвердили высокую эффективность препарата Алфлутоп® у пациентов с ОА как при стандартной (20 в/м инъекций ежедневно по 1 мл), так и при альтернирующей (10 в/м инъекций через день по 2 мл) схеме терапии. Отмечались быстрое и значимое уменьшение боли, скованности, улучшение функционального состояния и качества жизни пациентов. Установлено дальнейшее улучшение всех анализируемых показателей и после прекращения инъекций, что подтверждает наличие у этого препарата эффекта последействия.
Известно, что применение инъекционных форм SYSADOA имеет преимущества по сравнению с использованием пероральных препаратов: более быстрое развитие анальгетического эффекта (в нашем исследовании статистически значимое уменьшение боли выявлено уже на 20–21-й день); большая приверженность терапии; кроме того, пациенты зачастую более позитивно относились к парентеральному лечению, рассматривая его как более эффективное. Важно отметить, что в проведенном открытом рандомизированном многоцентровом исследовании не отмечено межгрупповых различий ни по одному из анализируемых показателей эффективности терапии. Таким образом, для увеличения комплаентности пациентов можно использовать не только стандартную (1 мл в/м ежедневно №20), но и альтернирующую (2 мл в/м через день №10) схему терапии.
Результаты нашего исследования согласуются с данными ранее опубликованных работ, в том числе многоцентровых слепых рандомизированных плацебо-контролируемых, в которых изучался терапевтический потенциал препарата Алфлутоп®. Сегодня только некоторые из представленных на российском рынке парентеральных форм препаратов группы SYSADOA отвечают требованиям доказательной медицины [8, 9]. Так, весьма демонстративны результаты проведенного нами ранее многоцентрового двойного слепого плацебо-контролируемого исследования, посвященного оценке не только симптоматического, но и структурно-модифицирующего эффекта препарата Алфлутоп®. В это двухлетнее исследование было включено 90 пациентов, которые методом рандомизации были распределены в две группы, сопоставимые по всем клинико-демографическим показателям. Пациенты 1-й группы (n=45) получали в/м инъекции препарата Алфлутоп® по 1 мл курсами по 20 дней с 6-месячными интервалами (всего 4 курса), больные 2-й группы (n=45) – плацебо (инъекции 0,9% раствора NaCl) по той же схеме. Дополнительно пациенты обеих групп могли принимать ибупрофен 600–1200 мг/сут. Симптом-модифицирующее действие определяли по динамике боли, индекса WOMAC, EQ-5D, общего состояния здоровья по ВАШ и оценке эффективности лечения врачом/пациентом, ответ на терапию – по критерию OMERACT-OARSI.
Для изучения структурно-модифицирующего эффекта этого препарата всем пациентам исходно и через 2 года выполняли магнитно-резонансную томографию целевого сустава и рентгенографию коленных суставов в положении стоя при фиксированном сгибании (в прямой проекции) с использованием позиционной рамки. Рентгенограммы расшифровывали слепым методом (как относительно пациентов, так и проводимой терапии). Динамику рентгенологических изменений оценивали в баллах: по ширине медиальной щели коленного сустава и наличию остеофитов бедренной и большеберцовой костей. Дополнительно исследовали биохимические маркеры деградации хрящевой ткани (СТХ-II и СОМР) в начале исследования, через 3 мес и в конце наблюдения.
К моменту завершения исследования на фоне лечения препаратом Алфлутоп® отмечалось статистически значимо большее уменьшение боли, суммарного индекса WOMAC и всех его составляющих (боль, скованность, ФН) по сравнению с плацебо (р<0,05). Оценка качества жизни по опроснику EQ-5D продемонстрировала значимое улучшение в 1-й группе (р<0,005), в группе плацебо этот показатель существенно не изменился (р>0,05). Улучшение общего состояния здоровья достигнуто только у пациентов, получавших Алфлутоп® (р<0,005). Хороший клинический потенциал препарата был подтвержден и по критерию OMERACT-OARSI – лечение оказалось эффективным у 73% пациентов 1-й группы и только у 40% группы плацебо (р=0,001).
Об успешном применении препарата Алфлутоп® свидетельствовало и снижение потребности в НПВП: в 1-й группе 21% больных полностью отказались от их приема, а 79% смогли снизить дозу; во 2-й группе уменьшили суточную дозу только 23% пациентов. Прекращение приема или снижение суточной дозы НПВП следует рассматривать как дополнительный положительный эффект при лечении ОА, поскольку это способствует уменьшению риска развития НР, характерных для этого класса препаратов, в первую очередь со стороны желудочно-кишечного тракта и сердечно-сосудистой системы.
Результаты проведенного многоцентрового двойного слепого плацебо-контролируемого исследования продемонстрировали структурно-модифицирующий эффект препарата Алфлутоп®. Так, на фоне его применения наблюдалось замедление прогрессирования ОА: сужения суставной щели или появления/увеличения остеофитов коленных суставов по сравнению с плацебо (OP=1,5; 95% ДИ 1,17–1,99; р<0,003). Также в 1-й группе уже после 3 мес лечения отмечена тенденция к снижению содержания маркера деградации хрящевой ткани CTX-II, сохранявшаяся до конца исследования, в то время как в группе плацебо, напротив, выявлено незначительное нарастание уровня как CTX-II, так и СОМР, что может косвенно указывать на прогрессирование заболевания.
Заключение
Таким образом, Алфлутоп®, оказывающий анальгетическое, противовоспалительное и структурно-модифицирующее действие, является препаратом выбора при лечении пациентов с ОА. На сегодняшний день накоплен большой опыт применения препарата у больных ОА, свидетельствующий о его высокой эффективности.
В нашем исследовании подтверждена эффективность препарата Алфлутоп® как при стандартной, так и альтернирующей схеме применения. У пациентов обеих групп был продемонстрирован быстрый сопоставимый анальгетический эффект. Это позволяет рекомендовать использование альтернирующей схемы терапии (Алфлутоп® по 2 мл в/м через день №10), что, возможно, будет способствовать повышению приверженности пациентов терапии, особенно при наличии коморбидных заболеваний и состояний. Достоинством данной работы является то, что она проводилась и контролировалась независимой контрактно-исследовательской организацией строго в соответствии с действующим законодательством и нормативными требованиями.