Резюме
Целью исследования являлась оценка гастропротективного эффекта препарата Алфлутоп, раствор для инъекций (К.О. Биотехнос С.А., Румыния) на модели развития гастропатии у крыс, вызванной приемом диклофенака.
Материалы и методы: Крысам ежедневно (20 дней) вводили Алфлутоп (внутримышечно) и диклофенак (внутрижелудочно). Для определения уровня содержания простагландинов в гомогенатах желудков были сформированы 4 группы по 20 крыс (на 21-й день – эвтаназия 50% животных из каждой группы, на 41-й день – оставшихся); для патоморфологического исследования желудков – 2 группы по 20 крыс (на 21-й день – эвтаназия 50% животных из каждой группы, на 35-й день – оставшихся).
Результаты: Диклофенак привел к развитию повреждений слизистой оболочки желудка. У 30% животных, получавших диклофенак сочетанно с препаратом Алфлутоп, патологических отклонений не выявлено, тогда как у 100% животных, получавших только диклофенак, наблюдались патологические изменения. На 35-й день исследования выявлено снижение частоты и выраженности десквамации эпителия в группе, получавшей Алфлутоп и диклофенак, по сравнению с контролем. Анализ уровня простагландинов (ПГ) в гомогенатах желудка показал, что диклофенак снизил уровни PGE2, PGF2α и метаболита PGI2 – 6-keto-PGF1α. После отмены диклофенака уровни ПГ продолжали снижаться, наиболее существенным было снижение PGF2α и 6-keto-PGF1α (до 16 и 20 раз) по сравнению с контролем. Алфлутоп привел к нормализации уровней PGE2 и 6-keto-PGF1α к 41-му дню эксперимента, нормализация уровня PGF2α, сниженного на фоне введения диклофенака, произошла на 21-й день, на 41-й день концентрации PGF2α превышали значения контрольной группы.
Заключение. Таким образом, Алфлутоп способствовал более быстрому восстановлению нарушенного в результате приема диклофенака синтеза ПГ. Обсуждаются возможные механизмы гастропротективного действия препарата Алфлутоп.
Материалы и методы исследования
Введение
Одним из наиболее серьезных побочных эффектов терапии с применением нестероидных противовоспалительных препаратов (НПВП) является их негативное воздействие на органы желудочно-кишечного тракта (ЖКТ), приводящее к формированию эрозивно-язвенных повреждений слизистой оболочки желудка (СОЖ). Причиной этого является механизм противовоспалительного действия НПВП, который связан с ингибированием активности циклооксигеназ. Поскольку ЦОГ участвуют в синтезе простагландинов (ПГ), ингибирование активности изоформ этого фермента неизбежно приводит к уменьшению продукции в СОЖ основных гастропротективных простагландинов [1-3], которые участвуют в формировании защитного слизистого слоя желудка от агрессивного воздействия соляной кислоты.
Повреждающее действие НПВП на слизистую оболочку желудка и двенадцатиперстной кишки определяется термином «НПВП гастропатия», и характеризуется появлением желудочных и дуоденальных эрозий/язв и развитием осложнений (кровотечений и перфораций) в результате приема НПВП [4, 5]. Степень повреждения органов ЖКТ зависит от специфичности действия НПВП в отношении изоформ ЦОГ. По данным клинических исследований, на фоне приема селективных НПВП наблюдается меньшая частота развития осложнений в отношении органов ЖКТ по сравнению с приемом неселективных НПВП [6].
Единственным классом лекарственных средств, доказавших свою эффективность в плане предотвращения НПВП-вызванной гастропатии, являются ингибиторы протонной помпы, что подтверждено многочисленными клиническими исследованиями и опытом использования данной группы препаратов в клинической практике [7]. Поскольку неселективные НПВП широко применяются в клинической практике, проблема поиска сопутствующей терапии, направленной на предотвращение развития НПВП-индуцированных гастропатий, является актуальной задачей.
Одним из перспективных направлений терапии патологий ЖКТ является использование препаратов биологического происхождения, преимуществами которых является их комплексное фармакологическое действие и хорошая переносимость. Алфлутоп обладает широким спектром эффектов, оказывая хондропротекторное и противовоспалительное действие, обладает анальгезирующим эффектом, регенераторной активностью, регулирует обмен веществ в хрящевой ткани. Препарат имеет сложный механизм действия. Компоненты препарата подавляют активность гиалуронидаз и биосинтез медиаторов воспаления; обладают антиоксидантным (за счет стимуляции активности супероксиддисмутазы) и гастропротективным действиями [8]. При проведении клинического исследования, в котором участвовали 20 пациентов с остеоартрозом и НПВП-индуцированной гастропатией, было показано, что применение препарата Алфлутоп является безопасным и эффективным средством для лечения остеоартрита, при этом он повышает эффективность стандартной противоязвенной терапии, ускоряя заживление язв и эрозий желудка и двенадцатиперстной кишки, возникших при приеме НПВП [9].
Предполагается, что механизм гастропротективного действия препарата Алфлутоп может быть обусловлен его влиянием на синтез простагландинов СОЖ. С целью проверки этой гипотезы в данном исследовании было изучено влияние Алфлутопа на количественное содержание основных гастропротективных ПГ – PGE2, PGF2α, простациклина PGI2 и его метаболита – 6-кето-PGF1α в гомогенатах желудка крыс на фоне применения НПВП. Также было оценено влияние Алфлутопа на количественное содержание ПГ в СОЖ в физиологических условиях, без применения НПВП. Для индукции НПВП-вызванной гастропатии у крыс использовали неселективный ингибитор ЦОГ – диклофенак.
Материалы и методы исследования
Животные
В эксперименте было использовано 120 самцов аутбредных крыс (питомник «НПО «ДОМ ФАРМАЦИИ») массой 230-270 г возрастом 10-12 недель. Исследование одобрено для проведения биоэтической комиссией исследовательского учреждения (№3.67/18 от 24 октября 2018 г.). Животных содержали в стандартных условиях окружающей среды и прозрачных пластиковых клетках группами по 5 особей.
Препараты
В исследовании использовали диклофенак, таблетки 50 мг, серия 0100618 (ООО «Хемофарм», Россия) и Алфлутоп, раствор для инъекций, серия 3360418 (К. О. Биотехнос С. А., Румыния). Для приготовления доз для введения диклофенак растворяли в воде дистиллированной и вводили внутрижелудочно (в/ж) в объеме 0,4 мл/кг. Раствор готовой лекарственной формы Алфлутопа вводили внутримышечно (в/м) в дозе 0,45 мл/кг.
Дизайн исследования
По результатам пилотного исследования определена доза препарата диклофенак – 4 мг/кг, при длительном (в течение 20-ти дней) применении которой у крыс развивались признаки гастропатии. Алфлутоп использовали в дозе 0,45 мл/кг, которая с учетом межвидового коэффициента пересчета доз соответствовала 5-ти терапевтическим клиническим дозам.
В основном эксперименте животные были разделены на 6 групп. Для определения уровня содержания простагландинов в гомогенатах желудков (PGЕ2; PGF2α; PGI2; 6-кето-PGF1α) сформированы группы №№ 1-4 по 20 крыс в каждой (на 21-й день – эвтаназия с помощью СО2-камеры 50% животных из каждой группы, на 41-й день – оставшихся). Для патоморфологического исследования желудков – группы №№ 5-6 по 20 крыс в каждой (на 21-й день – эвтаназия с помощью СО2-камеры 50% животных из каждой группы, на 35-й день – оставшихся). Индукцию патологии осуществляли путем ежедневного введения диклофенака всем группам, за исключением животных групп №№ 1 и 3, которые получали дистиллированную воду, в/ж. Терапию с применением Алфлутопа получали животные групп №№ 3, 4 и 6. Животные групп №№ 1, 2 и 5 получали физиологический раствор, в/м.
Патоморфологическое исследование
Степень повреждения СОЖ при макроскопическом исследовании оценивали по степени выраженности патологических изменений полуколичественно в баллах: 0 – отсутствие изменений; 1 – слабо выраженные изменения; 2 – умеренно выраженные изменения; 3 – выраженные изменения. Точечные геморрагии и язвы: 0 – отсутствие; 1 – единичные; 2 – множественные.
У животных групп №№ 5 и 6 для гистологического исследования были взяты образцы ткани желудка. По общепринятой методике изготавливали срезы, которые окрашивали гематоксилином и эозином. Анализ гистологических препаратов проводили при помощи светооптического микроскопа Accu-Scope 3000 ("Аccu-Scope", США) при увеличении 50 и 400.
Степень повреждения СОЖ при гистологическом исследовании оценивали по каждому из патологических признаков по степени выраженности полуколичественно в баллах: 1 – слабо выраженные изменения; 2 – умеренно выраженные изменения; 3 – выраженные изменения. Эрозии и язвы: 0 – отсутствие; 1 – наличие.
Определение количественного содержания простагландинов в слизистой оболочке желудка
Сразу же после извлечения желудки животных групп №№1-4 промывали в охлажденном физиологическом растворе, помещали в жидкий азот на 30 секунд и замораживали при –80°С.
Для получения гомогенатов использовали 0,1М фосфатный буферный раствор (pH=7,4), содержащий 1 мМ ЭДТА и 10 мкМ индометацина) в соотношении 1:9. Образцы гомогенизировали с помощью измельчителя тканей Polytron ("Kinematica AG", Швейцария). Гомогенаты центрифугировали при 8000 g в течение 10 мин.
В гомогенатах определяли концентрацию простагландинов E2, F2α, 6-кето-PGF1α и простациклина (PGI2) с помощью ИФА-наборов «Prostaglandin E2 Elisa Kit-Monoclonal, №514010», «Prostaglandin F2α Elisa Kit, №516011», «6-keto Prostglandin F1α Elisa Kit, №515211» (CaymanChemical, США) и ELISA Kit for Prostacyclin (PGI2), №CEA727Ge (Cloud Clone Corp., США). Перед началом анализа аликвоты гомогенатов желудка разбавляли буферным раствором для проведения ИФА-анализа (Elisa Buffer), входящим в состав наборов: для определения концентрации PGE2 и PGF2α – в 1000 раз, 6-keto-PGF1α – в 10000 раз, PGI2 – в 100 раз. Концентрация простагландинов рассчитана с учётом разбавления.
Концентрацию общего белка в гомогенатах желудка определяли биуретовым методом с помощью набора реагентов "Liquick Cor -Total protein" (№2 2-236, P.Z. Cormay S.A., Польша).
Для оценки данных с признаками нормального распределения использован однофакторный дисперсионный анализ (ANOVA) с последующим межгрупповым сравнением с использованием теста Тьюки. Для анализа данных двух выборок с признаками нормального распределения использован t-критерий Стьюдента, а для данных, не подчиняющихся закону нормального распределения – критерий Манн-Уитни. Различия были определены при уровне значимости р<0,05. Статистический анализ выполняли с помощью программного обеспечения Statistica 10.0 (StatSoft, США).
Результаты исследования
Результаты
Патоморфологического исследования
Введение диклофенака привело к развитию катарального гастрита, десквамации эпителия, в некоторых случаях наблюдались эрозивно-язвенные поражения СОЖ.
Выявлено значимое снижение частоты и выраженности десквамации эпителия на 35-й день эксперимента в группе, получавшей Алфлутоп, по сравнению с контролем (р<0,05, критерий Манн-Уитни). По результатам макроскопического исследования в группе, получавшей терапию Алфлутопом, частота встречаемости патологических изменений по сравнению с контролем была снижена на 30% как по окончании периода введения, так и после периода восстановления.
Определения уровня простагландинов в слизистой оболочке желудка
При проведении однофакторного дисперсионного анализа данных установлено значимое (р<0,05) влияние фактора «группа» на концентрацию всех исследованных ПГ как на 21-й, так и на 41-й дни эксперимента. 20-дневное введение диклофенака привело к значимому снижению уровней PGE2, PGF2α и 6-keto-PGF1α по сравнению с группами, не получавшими НПВП (рисунки 1-3).
После отмены диклофенака за 20 дней не произошло восстановления уровня ПГ, а наблюдалось еще большее снижение их концентраций по сравнению с 21-м днем эксперимента (рисунки 1-3). Алфлутоп существенно не повлиял на уровень ПГ у здоровых животных. При парном сравнении данных по каждому показателю, полученных на 21-й и 41-й день, выявлено статистически значимое увеличение уровней PGF2α и 6-keto-PGF1α на 41-й день эксперимента в группе без индукции патологии, получавшей Алфлутоп, что предположительно, вызвано индивидуальной вариабельностью показателей, поскольку полученные результаты статистически значимо не отличаются от данных контрольной группы №1 (критерий Тьюки, р>0,05, рисунки 3 и 4).
У животных со сформированной гастропатией терапия с использованием Алфлутопа привела к нормализации уровня PGE2 и 6-keto-PGF1α к 41-му дню эксперимента, а нормализация сниженного на фоне введения диклофенака уровня PGF2α произошла уже на 21-й день исследования. На 41-й день концентрации PGF2α превышали уровень группы контроля (рисунки 1-3).
Уровень простациклина был значительно ниже, чем уровень других ПГ. Наблюдалась тенденция к снижению PGI2 на фоне введения диклофенака на 21-й день, Алфлутоп не повлиял на данный показатель. Действительно, более информативной для оценки влияния препаратов на уровень PGI2 стала оценка количественного содержания его более стабильного метаболита 6-keto-PGF1α (рисунок 3).
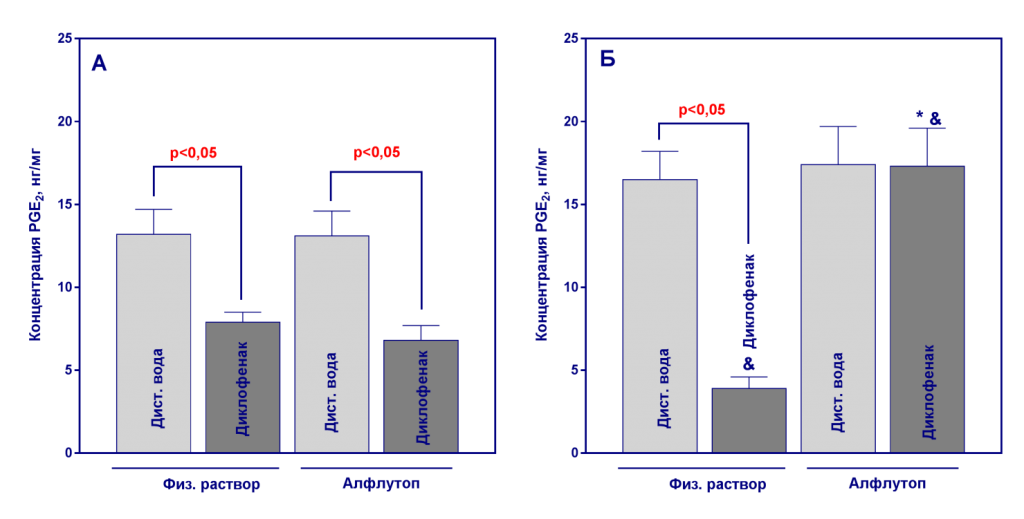
Рисунок 1
Количественное содержание PGE2 в гомогенатах желудка по окончанию терапии препаратом Алфлутоп (21-й день эксперимента, А) и через 20 дней периода восстановления (41-й день эксперимента, Б). Данные представлены как среднее значение ± ошибка среднего, n=10. *- р<0,05, статистически значимые отличия от контрольной группы, получавшей диклофенак, критерий Тьюки; & - р<0,05, статистически значимые отличия от соответствующей группы на 21-й день эксперимента, t-тест.
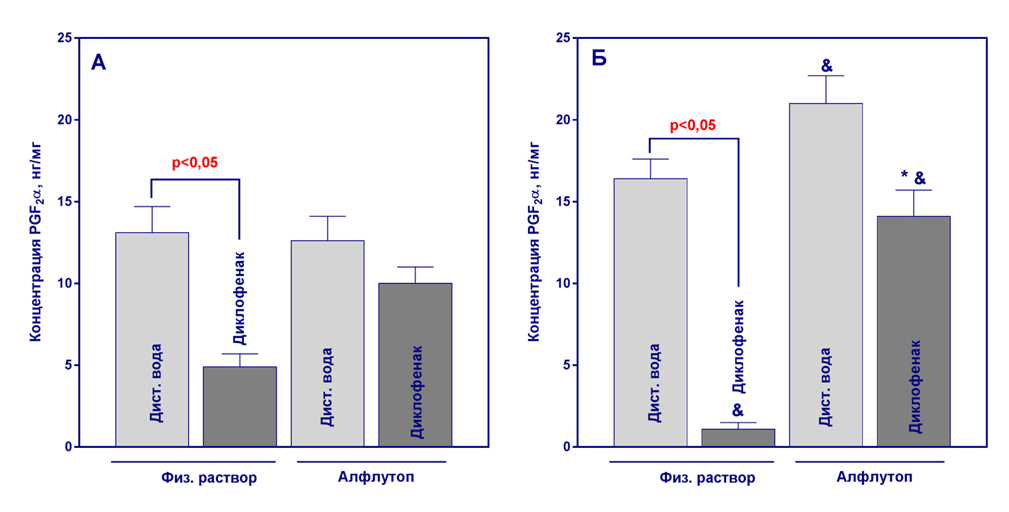
Рисунок 2
Количественное содержание PGF2α в гомогенатах желудка по окончанию терапии препаратом Алфлутоп (21-й день эксперимента, А) и через 20 дней периода восстановления (41-й день эксперимента, Б). Данные представлены как среднее значение ± ошибка среднего, n=10. *- р<0,05, статистически значимые отличия от контрольной группы, получавшей диклофенак, критерий Тьюки; & - р<0,05, статистически значимые отличия от соответствующей группы на 21-й день эксперимента, t-тест.
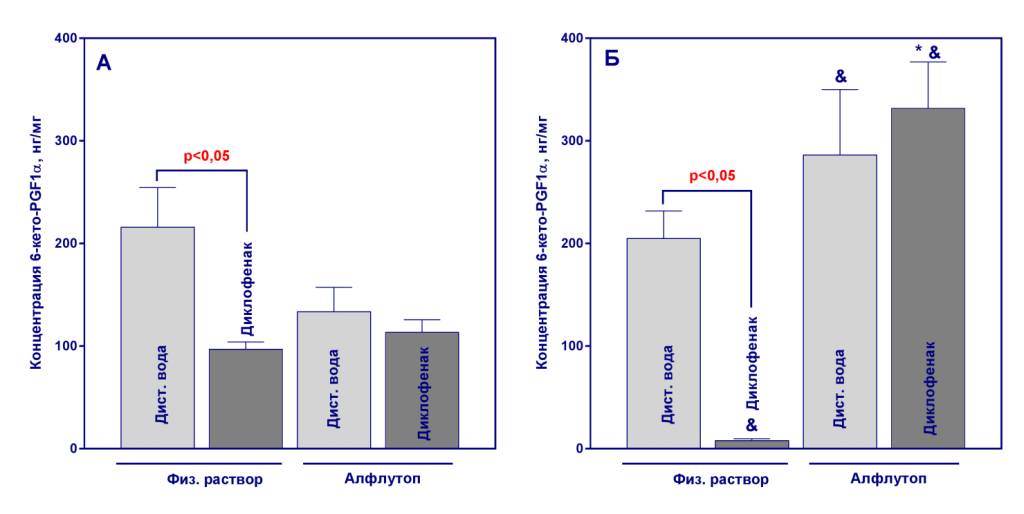
Рисунок 3
Количественное содержание 6-кето-PGF1α в гомогенатах желудка по окончанию терапии препаратом Алфлутоп (21-й день эксперимента, А) и через 20 дней периода восстановления (41-й день эксперимента, Б). Данные представлены как среднее значение ± ошибка среднего, n=10. *- р<0,05, статистически значимые отличия от контрольной группы, получавшей диклофенак, критерий Тьюки; & - р<0,05, статистически значимые отличия от соответствующей группы на 21-й день эксперимента, t-тест.
Обсуждение результатов
Введение диклофенака в течение 20-ти дней привело к развитию повреждений СОЖ, характеризующихся развитием катарального гастрита, десквамации эпителия, в некоторых случаях наблюдались эрозивно-язвенные поражения слизистой. На 35-й день выявлено значимое снижение частоты и выраженности десквамации эпителия в группе, получавшей Алфлутоп, по отношению к контролю.
Полученные данные показали, что курсовое введение диклофенака привело к снижению уровней PGE2, PGF2α и 6-keto-PGF1α. Уровень PGE2 непосредственно после окончания приема диклофенака был снижен на 40%, что сопоставимо с клиническими данными. Показано, что снижение уровня PGE2 на 50-76% происходит при курсовом приеме (от 7 до 30 дней) неселективных ингибиторов ЦОГ здоровыми добровольцами [10, 11].
Без назначения противоязвенной терапии прекращение курса приема НПВП не приводит к восстановлению СОЖ в течение 1–3 месяцев [5]. Изучение отсроченного эффекта приема НПВП в клинике на здоровых добровольцах показало, что длительный прием ацетилсалициловой кислоты (81 мг, 45 дней, ежедневно) подавлял синтез PGE2 и PGF2α СОЖ, уровни ПГ через 72 ч не достигли значений контрольной группы [12]. У крыс после однократного введения ряда как селективных, так и неселективных НПВП, через 24 часа наблюдалось существенное (до 10-ти раз по сравнению с группой контроля) снижение PGE2 и PGF2α в СОЖ, через 14 дней восстановительного периода уровень этих ПГ все еще был значимо снижен после введения ряда препаратов [13]. В проведенном эксперименте наиболее существенным было отсроченное снижение уровней PGF2α и 6-keto-PGF1α (в 16 и 20 раз, соответственно) по отношению к данным группы, не получавшей диклофенак. Для крыс характерна высокая чувствительность к эффектам НПВП в плане влияния на синтез ПГ. Даже однократное введение неселективного НПВП (индометацин, 100 мг/кг) приводило к снижению уровня PGE2 в гомогенатах желудка на 44,1% по сравнению с группой контроля [14]. Следует отметить, что в проведенном эксперименте период введения НПВП был длительным (20 дней), что превышает обычный рекомендованный курс приема НПВП в клинике (не более 7-ми дней). Вероятно, на нормализацию процесса синтеза ПГ после длительного курса приема необходимо большее количество времени.
Терапия с использованием Алфлутопа способствовала нормализации уровня PGE2 и 6-keto-PGF1α к 41-му дню эксперимента, восстановление сниженного на фоне введения диклофенака уровня PGF2α произошло уже на 21-й день исследования, а на 41-й день концентрация PGF2α превышала уровень контрольной группы.
При применении ингибиторов ЦОГ нарушается соотношение количества простагландинов и лейкотриенов в сторону преобладания последних, так как в результате подавления ЦОГ начинает преобладать синтез продуктов липоксигеназного пути превращения арахидоновой кислоты [15]. Также причиной возникновения нежелательных реакций может стать и нарушение баланса соотношения PGE2/PGF2. Алфлутоп может обладать ингибирующей активностью в отношении ферментов 5-ЛОГ и ЦОГ-2, как было показано для пептидно-фосфолипидного комплекса биологического происхождения, полученного из печени трески [16, 17]. Можно предположить, что Алфлутоп, снижая активность 5-ЛОГ, препятствует усилению дисбаланса между синтезом лейкотриенов и простагландинов и тем самым позволяет быстрее нормализовать синтез ПГ после отмены диклофенака.
Алфлутоп обладает антигиалуронидазной активностью и нормализует биосинтез эндогенной гиалуроновой кислоты, что также может обусловливать его влияние на синтез ПГ. Данные последних лет показывают, что гиалуроновая кислота может обладать как противо-, так и провоспалительными свойствами, в зависимости от молекулярной массы молекулы: высокомолекулярные полимеры обладают противоспалительным действием, в то время как низкомолекулярные – провоспалительным [18]. В исследованиях in vitro (на клетках синовиальной жидкости пациентов, страдающих остеоартритом) показано, что гиалуроновая кислота в зависимости от дозы и молекулярной массы влияет на продукцию индуцированного IL-1β простагландина Е2 (PGE2) [19]. Ингибирующий эффект гиалуроновой кислоты на продукцию провоспалительных цитокинов снижается по мере уменьшения молекулярной массы полимера [20]. Соответственно, полимеры определенной массы могут оказывать стимулирующее влияние на локальный синтез ПГ.
В отношении хондроитина сульфата, входящего в состав препарата Алфлутоп, в исследованиях in vitro и in vivo была показана его противовоспалительная активность и влияние на белки и клеточные сигнальные каскады, участвующие в развитии воспалительного процесса, в том числе и на различные подтипы матричных металлопротеаз [21-23]. Эти факторы играют роль в развитии воспалительного процесса в клетках СОЖ [24].
Следует отметить, что комплексный состав препарата Алфлутоп предполагает, что в реализацию его гастропротективного эффекта могут быть вовлечены различные фармакологические механизмы, которые, в том числе, направленны на модуляцию активности ферментов, вовлеченных в каскад арахидоновой кислоты.
Таким образом, полученные данные свидетельствуют о наличии гастропротективного эффекта у тестируемого препарата Алфлутоп на фоне применения НПВП (диклофенак). Результаты определения уровня простагландинов свидетельствуют о том, что гастропротективный эффект обусловлен стимулирующим влиянием Алфлутопа на сниженный в результате приема диклофенака уровень простагландинов слизистой оболочки желудка.