Резюме
Люмбоишиалгия (ЛИ) встречается у 13–40% популяции, а ежегодная заболеваемость варьируется от 1 до 5% [1]. Хотя у большинства пациентов ЛИ имеет благоприятное течение, по данным разных исследований, боль сохраняется свыше 6 мес [2]. Самой распространенной причиной ЛИ являются дегенеративно-дистрофические изменения двигательных сегментов позвоночника – остеохондроз, спондилез, спондилоартроз и грыжа межпозвоночного диска (МПД) с компрессией либо раздражением корешка [3–5].Болевой синдром при ЛИ чаще носит смешанный характер, т. е. является ноцицептивным (за счет возбуждения болевых рецепторов МПД, фасеточных суставов, связок позвоночника, мышц спины и конечности) и невропатическим (за счет возникновения гиперактивности нервной ткани в зоне компрессии или ишемии). Контроль боли – важный компонент лечения ЛИ. Многочисленные терапевтические методы, применяемые в повседневной практике, могут частично облегчать боль, однако далеко не всегда обеспечивают полное восстановление физического состояния пациента. Проспективные наблюдения показывают, что отдаленные результаты консервативного лечения, включающего медикаментозные и физические методы, сопоставимы с исходами естественного течения заболевания [6] и единодушного мнения об эффективности терапевтических стратегий, используемых в настоящее время при боли в нижней части спины (БНС), нет. Поэтому значительный интерес представляет изучение патогенеза ЛИ.
По данным клинико-экспериментальных исследований, в процессах дегенерации МПД и развитии болевых ощущений важную роль играют воспалительные реакции [7, 8]. Наряду с механической компрессией воспалительные изменения МПД могут участвовать в формировании радикулярной боли [9, 10]. Компрессия нервных корешков приводит к тканевому повреждению, вызывая воспалительные реакции, которые могут быть одной из причин возникновения радикулопатии. Процесс дегенерации МПД характеризуется повышением уровня воспалительных цитокинов: фактора некроза опухоли (ФНО) α, интерлейкина (ИЛ) 1, ИЛ6 и ИЛ17 [11].
Провоспалительные молекулы секретируются клетками пульпозного ядра и фиброзного кольца, а также макрофагами, Т-клетками и нейтрофилами. Эти цитокины запускают каскад патофизиологических реакций со стороны клеток МПД, которые стимулируют аутофагию, ускоренное старение и апоптоз. В этом процессе участвуют различные продуцируемые в МПД провоспалительные факторы: ФНОα, ИЛ1, ИЛ6, ИЛ17, ИЛ8, ИЛ2, ИЛ4, ИЛ10, хемокины, простагландины. Наиболее изученными среди них являются ФНОα и ИЛ1 [12]. У пациентов с ЛИ выраженность боли коррелировала с концентрацией ИЛ1 в сыворотке (r=0,834) и ФНОα как в сыворотке крови (r=0,629), так и в биопсийном материале (r=0,65) [13].
В настоящее время поиск новых терапевтических мишеней и, соответственно, новых препаратов для эффективного контроля боли при этой патологии остается весьма актуальным. Одной из молекул, обладающих потенциальным терапевтическим эффектом при хроническом воспалении суставов, является хондроитина сульфат (ХС), который относится к симптоматическим средствам замедленного действия (Symptomatic Slow Acting Drugs for Osteoarthritis, SYSADOA). ХС представляет собой гетерогенный класс полисахаридов, что обусловлено наличием разного числа сульфатных групп, присоединяющихся в различных позициях, и различиями в молекулярной массе. В одном из ранних исследований in vitro было показано, что ХС увеличивает содержания РНК в хондроцитах, коррелирующее с повышением синтеза протеогликана и коллагена, ингибирует активность лейкоцитарной эластазы. Способность ХС угнетать эластазу нарастает с увеличением молекулярной массы и количества сульфатированных N-ацетилгалактозаминовых остатков во 2-м, 4-м и 6-м положениях [14].
Имеется большое число исследований клинической эффективности и безопасности SYSADOA при хронической суставной боли [15–17]. Эффективность ХС при остеоартрите (ОА) была оценена в Кокрановском метаанализе: продемонстрировано снижение интенсивности боли при равном или меньшем числе нежелательных явлений (НЯ) по сравнению с плацебо [18]. В 2018 г. проведен метаанализ, включавший 26 статей, содержавших данные 30 рандомизированных контролируемых исследований (РКИ). В этих РКИ участвовали пациенты с первичным ОА тазобедренного и/или коленного сустава с клиническим и/или рентгенологическим диагнозом. На фоне терапии как минимум двумя из следующих пероральных препаратов: глюкозамином, ХС или их комбинацией по сравнению с плацебо изучались такие параметры, как боль, функция, скованность и НЯ. По данным метаанализа, ХС показал лучший обезболивающий эффект при сопоставлении с плацебо (для оценки величины эффекта использовалась стандартизированная разница средних, которая в данном случае была равна -0,540; 95% доверительный интервал, ДИ от -0,900 до 0,178), глюкозамин не имел существенного преимущества перед плацебо (величина эффекта -0,263; 95% ДИ от -0,635 до 0,113). Комбинация глюкозамина с ХС также не превосходила по эффективности плацебо (величина эффекта 1,980; 95% ДИ от -0,740 до 4,700). В целом сравнительная оценка ХС и плацебо показала, что ХС может облегчать боль и улучшать функцию. В то же время глюкозамин имел преимущество перед плацебо только по влиянию на функциональный статус [19].
Препарат Алфлутоп, представляет собой оригинальный стандартизированный биоактивный концентрат из четырех видов мелких морских рыб (БКММР). В его состав входят сульфатированные гликозаминогликаны, аналогичные соответствующим компонентам матрикса гиалинового хряща: хондроитин-4-сульфат, хондроитин-6-сульфат, дерматансульфат, кератансульфат, низкомолекулярные полипептиды, свободные аминокислоты и микроэлементы (натрий, калий, кальций, магний, железо, медь, цинк), необходимые для обменных процессов и метаболизма соединительной ткани в целом.
Препарат оказывает многокомпонентное действие: влияет на метаболизм хондроцитов, стимулируя синтез макромолекул матрикса, что подтверждается иммуноферментным анализом внеклеточных уровней аггрекана и аггреканазы. Он также увеличивает содержание аггрекана на 60,49% и одновременно снижает уровень внеклеточной аггреканазы на 26,71%. Препарат обладает антигиалуронидазной активностью и стимулирует синтез гиалуроновой кислоты, повышая ее уровень в синовиальной жидкости на 70% [20]. Отмечен антиоксидантный эффект препарата: уменьшение содержания внутриклеточного супероксид аниона на 31% и пероксида водорода на 50% [21]. Кроме того, он обладает способностью уменьшать выраженность синовита и боли, подавляя внеклеточное высвобождение ИЛ6 на 24% и ИЛ8 на 45% [22].
Алфлутоп вводится внутримышечно (в/м) и внутрисуставно (в/с). Для получения более быстрого эффекта эти способы введения можно сочетать [23, 24]. Благодаря комплексному действию препарат можно использовать у пациентов с вертеброгенной ЛИ. Известно, что у 15–45% пациентов БНС обусловлена фасеточным синдромом [25]. О.С. Левин и соавт. [26] в плацебо-контролируемом исследовании эффективности Алфлутопа у пациентов с вертеброгенной ЛИ продемонстрировали также возможность паравертебрального (п/в) введения препарата.
Материалы и методы исследования
Пациенты и методы. В открытое проспективное РКИ было включено 30 пациентов (22 мужчины и 8 женщин), госпитализированных в неврологическое отделение Республиканского клинического неврологического центра (Казань) в связи со стойкой (более 3 мес) ветеброгенной ЛИ. Все больные получали терапию в соответствии с используемым в клинике стандартом [27]: нестероидные противовоспалительные препараты – НПВП (диклофенак по 100 мг/сут или кетопрофен по 150 мг/сут), лечебную физкультуру, физиолечение (магнитотерапия на пояснично-крестцовую область, синусоидальные модулированные токи и инактивация миофасциальных триггерных точек в большой и средней ягодичной мышцах, собственных мышцах спины методом локальной инъекционной терапии с применением 0,5% раствора новокаина либо 1% раствора лидокаина). Оценка изучаемых параметров проводилась во время 4 визитов. Визит 1 соответствовал 1-му дню госпитализации, визит 2 – 20-му дню (±1 день) терапии (завершение лечения). Визит 3 проходил заочно, через 60 дней (±3 дня) после начала лечения: по телефону пациента просили оценить интенсивность боли в поясничной области по визуальной аналоговой шкале (ВАШ). На заключительный визит 4, на 90-й (±3) день, пациентов приглашали для очного обследования.
В ходе трех очных визитов оценивали: неврологический статус; интенсивность боли по ВАШ; индекс активности боли в поясничном отделе (Sciatica Bothersomeness Index, SBI), состоящий из индекса частоты и индекса выраженности ишиалгии; степень ограничения повседневной активности по опроснику Роланда–Морриса и опроснику качества жизни EQ-5D (European Quality of Life Instrument). На момент визита 3 определяли только интенсивность боли в поясничной области по ВАШ. При исследовании мышечной силы использовали 6-балльную шкалу Совета по медицинским исследованиям Великобритании (Medical Research Council Weakness Scale, MRC). Также при каждом визите собирали информацию о возможных НЯ.
Критерии включения в исследование: возраст от 18 до 65 лет; наличие дегенеративно-дистрофических изменений позвоночника, подтвержденное при магнитно-резонансной (МРТ) или компьютерной (КТ) томографии; наличие результатов КТ или МРТ, проводившейся не более 2 лет назад; наличие боли в области пояснично-крестцового отдела длительностью более 3 мес (сопутствующий болевой синдром другой локализации, и/или ОА, и/или остеохондроз не являлись критерием невключения); наличие стабильной клинической картины заболевания (отсутствие прогрессирования и новых симптомов за последние 3 мес); оценка боли по ВАШ >40 мм; отсутствие противопоказаний к в/м введению препаратов; отсутствие указаний в анамнезе на непереносимость препарата; подписанное информированное согласие на участие в исследовании.
Критерии невключения: применение SYSADOA в течение последних 3 мес; введение глюкокортикоидов за 1 мес до начала исследования; соматические заболевания в стадии декомпенсации; органические заболевания нервной системы, психические заболевания; травмы головного мозга и позвоночника в анамнезе; секвестрированные грыжи в анамнезе или выявленные на этапе скрининга; нефиксированный спондилолистез >5 мм; склонность к кровоточивости, тромбофлебит в анамнезе; применение антикоагулянтов прямого и непрямого действия; беременность или лактация; перенесенные хирургические вмешательства на позвоночнике; другие состояния, которые делают участие пациента в исследовании невозможным (по мнению врача).
Больные были рандомизированы методом конвертов в две группы: 15 пациентов 1-й группы в дополнение к стандартной терапии получали Алфлутоп (2 мл в/м через день, всего 10 инъекций), а 15 пациентов 2-й группы (контроль) – стандартную терапию. Группы пациентов не различались по полу, возрасту и антропометрическим показателям (табл. 1). Статистический анализ проводился с помощью программ Excel и Origin. Для оценки межгрупповых демографических различий использовался критерий χ2 и точный критерий Фишера, для оценки межгрупповых различий по антропометрическим показателям – Критерий Манна–Уитни. Для анализа внутригрупповой динамики боли по ВАШ, счета по опроснику Роланда–Морриса, индекса частоты и выраженности ишиалгии, качества жизни по EQ-5D применялся критерий Фридмана. Межгрупповой анализ боли по ВАШ, индекса выраженности ишиалгии (SBI) выполняли с помощью критерия Манна–Уитни с поправкой Бонферрони; сравнение индекса частоты и выраженности ишиалгии, качества жизни по EQ-5D и данных по опроснику Роланда–Морриса – с помощью критерия Фридмана и критерия Манна–Уитни. Данные по гендерному составу групп представлены в процентах; по возрасту, антропометрическим показателям, интенсивности боли по ВАШ, оценке качества жизни по EQ-5D, индексу SBI (частота и выраженность ЛИ) и опроснику Роланда–Морриса – как медиана и интерквартильный интервал (Ме [25-й; 75-й перцентили]); для построения графиков по абсолютным значениям шкал и опросников (по визитам) использованы соответствующие визитам значения медиан показателей. Различия считали значимыми при p<0,05.

Исследование одобрено локальным этическим комитетом ГАУЗ «Республиканский клинический неврологический центр» (протокол заседания №3/2 от 25.03.2021). Все пациенты подписали информированное согласие на участие в исследовании.
Результаты исследования
Основной жалобой пациентов была боль в поясничном отделе позвоночника с распространением в ягодицу, далее по задней или заднебоковой поверхности бедра и голени. Боль носила механический характер – усиливалась при ходьбе, наклонах, поворотах в кровати и облегчалась в покое. Также все пациенты при описании боли использовали дескрипторы невропатической боли («колющая», «жгучая», «стреляющая»), указывали на чувство «онемения» в ноге. При этом не отмечалось клинических признаков центральной сенситизации (симметричной, блуждающей, широко распространенной боли, аллодинии или гипералгезии, выходящих за предполагаемые границы боли). У части пациентов имелись легко выраженные (≥4 балла по шкале MRC) парезы разгибания либо сгибания стопы.
Интенсивность боли по ВАШ к началу терапии в 1-й и 2-й группах не различалась: медиана боли составляла 70 мм. При этом одинаковое число пациентов обеих групп испытывали умеренную (от 45 до 74 мм) и сильную (от 75 до 100 мм) боль (разделение боли на умеренную и сильную проведено в соответствии с рекомендациям G.A. Hawker и соавт. [28]).
К окончанию исследования отмечалось снижение интенсивности боли в обеих группах, которое было наиболее заметным в группе исследуемого препарата (рис. 1–3). К визитам 2 и 3, т. е. на 20-й (завершение терапии) и 60-й (±3 дня) дни после начала лечения, у пациентов, получавших БКММР, интенсивность боли была значимо ниже, чем в контрольной группе (табл. 2).
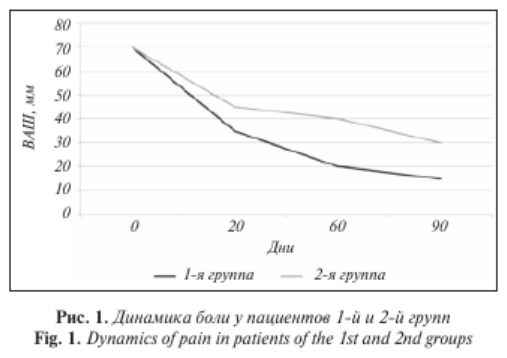

При этом к моменту последней инъекции исследуемого препарата (20-й день лечения) сильную боль не испытывал ни один пациент в двух группах, на умеренную боль указали 67% участников 2-й группы и только 7% больных 1-й группы. Через 60 дней после начала исследования об отсутствии боли сообщили 26% пациентов 1-й группы и 7% больных 2-й группы.
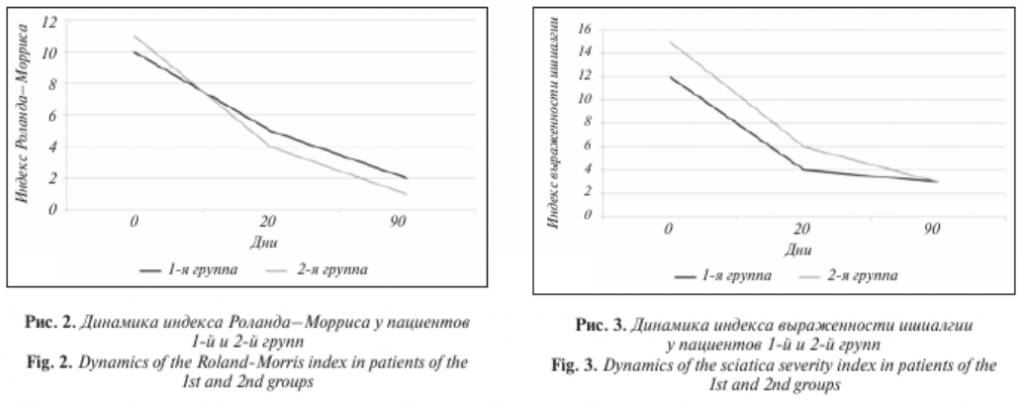
Исходно у пациентов обеих групп отмечалось выраженное нарушение жизнедеятельности по данным опросника Роланда–Морриса. Медиана счета в группе исследуемого препарата составила 10 баллов, в контрольной группе – 11 баллов. Через 20 дней констатировано улучшение: в группе исследуемого препарата и в контрольной группе счет значимо снизился до 5 и 4 баллов соответственно. Через 90 дней медиана счета по опроснику Роланда–Морриса в 1-й группе составила 2 балла, а во 2-й группе – 1 балл. Значимых межгрупповых различий через 20 и 90 дней после начала терапии не наблюдалось (см. рис. 2).
На момент визита 1 медиана выраженности ишиалгии оценивалась в 12 баллов в группе исследуемого препарата и в 15 баллов в контрольной группе. После 20 дней терапии выраженность ишиалгии значимо снизилась в обеих группах и равнялась 4 и 6 баллам соответственно. В 1-й группе положительная динамика была несколько более выраженной, но различия не достигали статистической значимости. К 90-му дню медиана выраженности ишиалгии составила 3 балла в обеих группах. При этом на протяжении исследования не зарегистрировано значимых межгрупповых различий (см. рис. 3).
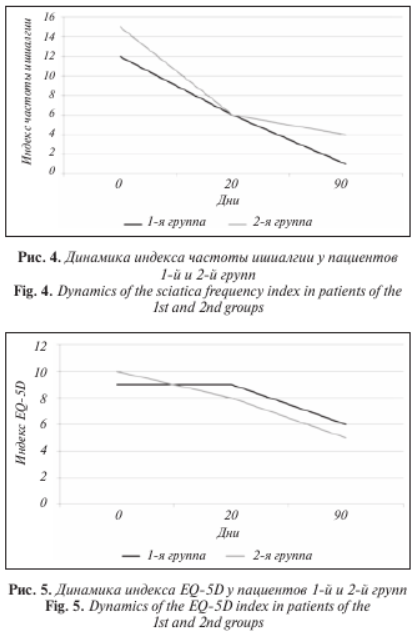
К началу лечения медиана индекса частоты ишиалгии (по шкале SBI) в группе исследуемого препарата составила 12, а в контрольной группе – 15 баллов. После 20 дней терапии в обеих группах она значимо снизилась до 6 баллов. Через 90 дней после начала лечения медиана индекса частоты ишиалгии составила 1 балл в группе исследуемого препарата и 4 балла в контрольной группе. Значимых межгрупповых различий не выявлено (рис. 4).
Пациенты обеих групп к началу терапии указывали на ухудшение качества жизни: в 1-й группе медиана EQ-5D достигала 9 баллов, а во 2-й группе – 10 баллов. В 1-й и 2-й группах через 90 дней после начала терапии качество жизни значимо улучшилось, и медиана индекса EQ-5D составила 6 и 5 баллов соответственно. Различий в динамике качества жизни между группами не отмечено (рис. 5).
Обсуждение результатов
Болевой синдром при вертеброгенной ЛИ характеризуется более длительным течением по сравнению с люмбалгией, что может приводить к астенизации пациентов и ухудшению комплаентности [29]. Задача быстрого уменьшения боли затрудняется из-за недостаточного эффекта НПВП и роста числа НЯ при их длительном применении. На практике снижение интенсивности боли дает пациенту возможность начать занятия лечебной физкультурой, он активнее вовлекается в лечебный процесс, у него появляется уверенность в правильном выборе терапевтической тактики, что крайне важно для купирования проявлений поражения двигательных сегментов позвоночника.За время использования Алфлутопа было проведено 10 клинических испытаний (КИ), в которых его эффективность оценивалась у 1397 пациентов с диагнозами «остеохондроз», «вертеброгенная люмбоишиалгия», «цервикобрахиалгия», «боль в спине», т. е. с патологией, которая может быть отнесена к НБС [30].
Помимо классической схемы курсового в/м введения, в ряде КИ изучались п/в или комбинированное использование этого препарата при НБС и даже его применение в рамках авторской методики лечения НБС (внутридисковое введение).
О непосредственном эффекте курса в/м инъекций Алфлутопа у пациентов с НБС свидетельствуют данные КИ, в которых показано снижение интенсивности боли на 43,2– 72,9% (в среднем на 61,2%). Особый интерес представляет двойное слепое плацебо-контролируемое исследование, выполненное в соответствии со стандартами доказательной медицины и ставшее подтверждением эффективности и безопасности БКММР при НБС [25]. В этой работе 83 больных с ЛИ получали Алфлутоп в/м по 1,0 мл №20 или п/в (в четыре точки по 0,25 мл №5), причем каждую из групп активной терапии сравнивали с соответствующей контрольной группой (в/м или п/в инъекции физиологического раствора). Проводилась оценка параметров, определяющих состояние пациентов с ЛИ. Применение исследуемого препарата в виде как в/м, так и п/в инъекций имело значимое преимущество по сравнению с плацебо. Так, число больных с хорошим или умеренным эффектом составило в группах активной терапии 61 и 69%, в группах контроля – 40 и 49% соответственно (p<0,05). Эффект исследуемого препарата развивался сразу после завершения курса лечения и имел тенденцию к нарастанию в первые 3 мес. Сравнение в/м и п/в введения Алфлутопа показало, что второй метод обеспечивает более быстрое улучшение, однако после 3 мес наблюдения различия в эффективности оказались статистически незначимыми. Таким образом, по отдаленным результатам терапии п/в и в/м введение препарата было сопоставимым.
В масштабном КИ (n=600), посвященном сравнению эффективности короткого курса в/м инъекций Алфлутопа (№10) и аналогичных курсов других SYSADOA для парентерального применения (глюкозамина сульфата, хондроитина сульфата и остеохондрина), БКММР значимо превосходил препараты контроля по частоте купирования боли (снижение до <30 мм по ВАШ) [31].
В другом КИ эффективность курса в/м инъекций Алфлутопа (1,0 мл №20) в комбинации с приемом НПВП сравнивалась с результатом использования только НПВП (мелоксикам 7,5 мг) у пациентов с НБС. Через 3 мес после начала терапии было отмечено статистически значимое преимущество БКММР в отношении купирования боли, улучшения функции (индекс Роланда–Морриса), динамики индекса активности боли в поясничном отделе (SBI), признаков невропатической боли (по опроснику Douleur Neuropathique 4 questions, DN4) и потребности в приеме НПВП [32].
В настоящем исследовании продемонстрировано, что добавление исследуемого препарата к стандартной терапии, проводимой в стационаре, позволяет к моменту выписки (на 20-й день) добиваться существенного улучшения результатов лечения. Стандартизированный многокомпонентный раствор Алфлутопа выпускается в строгом соответствии с технологией «Биотехнос» с контролем на всех этапах производства. Благодаря синергизму компонентов препарата создается клинический эффект, доказанный в ходе хорошо организованных КИ.
Отсутствие различий в интенсивности боли, счете по опросникам Роланда–Морриса и EQ-5D, индексах частоты и выраженности ишиалгии через 3 мес после начала терапии, на наш взгляд, объясняется тем, что в наблюдательном исследовании пациенты чаще, чем в реальной жизни, контактируют с лечащим врачом, который мотивирует их к соблюдению рекомендаций по двигательному режиму и помогает при возникновении каких-либо вопросов. Это значительно повышает комплаентность больных и, как следствие, может привести к улучшению результатов даже у пациентов, которые не получали исследуемый препарат, в частности Алфлутоп.
Таким образом, различия в интенсивности боли на 20-й и 60-й дни наблюдения должны коррелировать со степенью выраженности ЛИ, однако мы не наблюдали значимо большего снижения частоты и выраженности ЛИ у пациентов, получавших Алфлутоп. Это связано с отсутствием положительного влияния на корешковую боль и воздействием в основном на боль в пояснице, главными источниками которой являются МПД и фасеточные суставы.
Оценка качества жизни по EQ-5D также не выявила различий, что может объясняться тем, что корешковая боль, являясь невропатической, несмотря на невысокую интенсивность, ухудшает качество жизни пациента в большей степени, чем ноцицептивная боль из структур позвоночно-двигательного сегмента.